山东省药品监督管理局关于《药械化企业日常检查管理规范 第3部分日常检查》(征求意见稿)解读
政策公告 山东省
为规范药品、医疗器械、化妆品(以下简称药械化)企业日常检查管理,提升检查执法效能,为药监部门日常检查工作提供有力的技术支撑,推动药械化企业增强主体责任意识、风险防控意识和法律法规意识,加强自我管理,省药监局以《药品管理法》《药品生产监督管理办法》《医疗器械监督管理条例》《化妆品监督管理条例》《化妆品生产经营监督管理办法》等文件为基本前提,组织起草了《药械化企业日常检查管理规范 第3部分 日常检查》。
一、起草背景
2022年2月,省药监局下发《关于印发<山东省药品监督管理局药械化日常检查标准化试点工作方案>的通知》(鲁药监办﹝2022﹞3号),在一分局开展了为期一年的日常检查标准化试点工作,探索推出一批标准化工作流程模板。2022年10月,省药监局印发《关于推进分局规范化管理的实施方案》(鲁药监办﹝2022﹞12号),在全省六个分局推广应用试点创新经验。为推进日常检查科学化、法治化、标准化、规范化、信息化,实现日常检查“统一检查程序、统一检查内容、统一检查标准、统一数据管理”的目标,2023年10月,省药监局向山东省市场监督管理局提交了地方标准立项申请。
根据《山东省市场监督管理局关于印发居民基本养老保险办理服务规范等第三批地方标准计划项目的通知》(鲁市监标函〔2023〕303号),《药械化企业日常检查管理规范》系列地方标准列入2023年第三批山东省地方标准计划。本标准为系列标准中的第三部分(计划号2023-T-151)。
二、起草过程
2024年上半年,省药监局委托一分局在试点基础上,依托第三方技术服务机构技术力量,研究起草地方标准,并在征求省药监局各相关处室及其他分局意见后,形成标准的公开征求意见稿。
三、主要内容
本文件是《药械化企业日常检查管理规范》系列标准的第三部分,也是系列标准的主体部分,主要规定了药品、医疗器械、化妆品企业日常检查的检查范围、检查流程、检查实施过程以及检查后续工作等方面的要求。横向,在药品、医疗器械、化妆品企业日常检查工作的共性要求的基础上,考虑特殊要求形成了通用的流程与方法;纵向,按照日常检查工作的实施流程提出要求。
(一)明确了药械化企业日常检查适用的检查范围
第4章根据省药监局对区域检查分局职责职能的规定,明确了区域检查分局日常检查的主要范围。药品生产检查范围包括原料药生产、药品制剂生产、医疗机构制剂配制、医用氧气生产、中药饮片生产、药用辅料生产、药包材生产、中药提取物生产等;药品经营检查范围包括药品批发、药品零售连锁总部、药品网络交易第三方平台;医疗器械检查范围包括第二类和第三类医疗器械生产、医疗器械网络交易第三方平台;化妆品检查范围包括化妆品生产、化妆品网络交易第三方平台。
(二)提出了药械化企业日常检查的工作流程
2023年7月,国家药品监督管理局发布关于修订《药品检查管理办法(试行)》部分条款有关事宜的通知(国药监药管〔2023〕26号),要求“各省级药品监督管理部门应当按照本《办法》修订条款要求,结合本行政区域实际情况,统一工作标准,细化工作要求,优化工作程序,组织做好药品生产经营及使用环节检查……”。《办法》对“现场检查结论”及检查结论判定原则的修订与日常检查直接相关。本文件第5章提出的日常检查流程,是在原日常检查流程的基础上,融入了《办法》对检查流程的修订要求。经一分局前期试点工作的实践验证,该流程不仅适用于药品也适用于医疗器械和化妆品日常检查。具体流程如下:
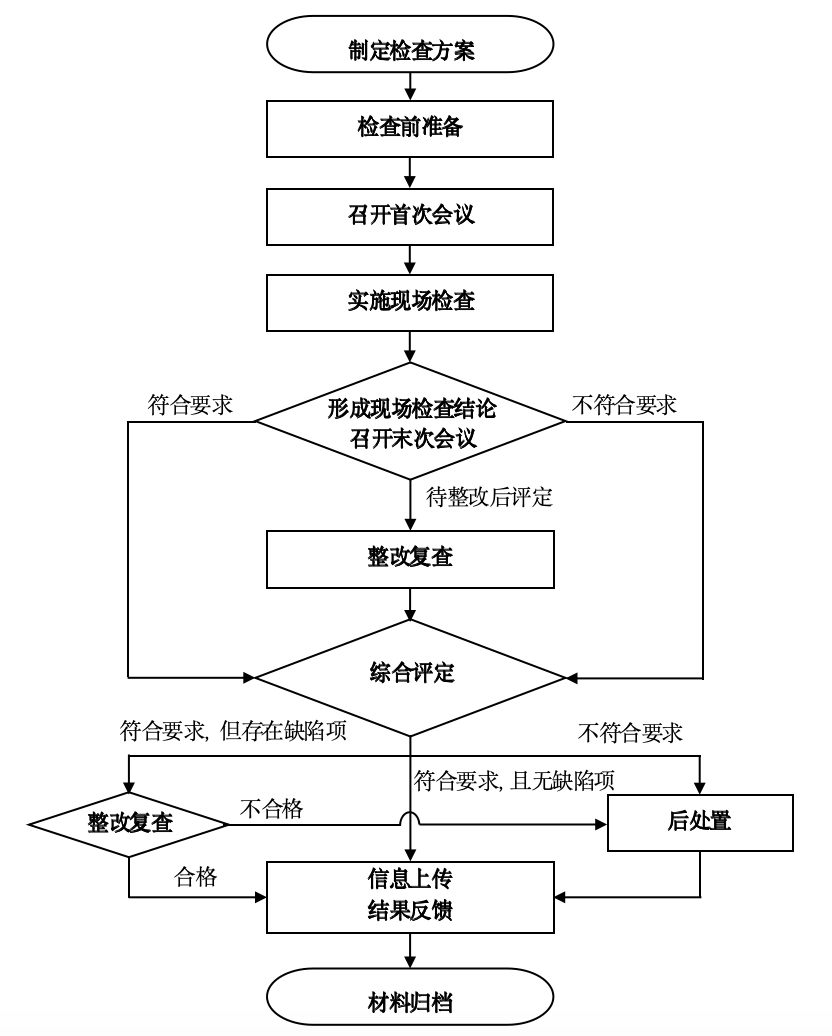
图 日常检查工作流程
修订后的《药品检查管理办法(试行)》,明确检查结论包括“符合要求”“不符合要求”和“待整改后评定”三种,现场检查情况满足当次检查依据的检查结论为“符合要求”,即通过本次检查。流程也能体现综合评定结果对后续措施与流程的决定性作用。
(三)明确了日常检查的具体实施要求
本文件第6、7、8、9、10章围绕日常检查流程,从现场检查前、现场检查和现场检查后三个方面展开说明实施相关的具体要求,一方面规定了检查人员开展检查工作的具体要求,一方面也可指导被检查对象明确要求,对标达标并履行相关配合义务。
1.现场检查前
第6章提出实施现场检查前的基本准备要求:一是强调检查方案编制的科学性、检查方案内容的完整性;二是强调检查人员能力的符合性,以及检查组在检查前的工作内容与职责。
2.现场检查
第7章规定现场检查主要包括检查前沟通、首次会议、实施检查、末次会议四个主要工作环节。本部分提出各环节的主要内容及实施重点要求,主要技术要点有:
(1)7.1、7.2条款明确了检查前沟通的内容及首次会议的告知义务,旨在提高日常检查的规范性,同时也体现了风险管理理念。
(2)《药品检查管理办法(试行)》(国药监药管〔2023〕26号)第四十条规定“常规检查包含以下内容:(一)遵守药品管理法律法规的合法性;(二)执行相关药品质量管理规范和技术标准的规范性;(三)药品生产、经营、使用资料和数据的真实性、完整性;(四)药品上市许可持有人质量管理、风险防控能力;(五)药品监督管理部门认为需要检查的其他内容。药品监督管理部门或者药品检查机构进行常规检查时可以采取不预先告知的检查方式,可以对某一环节或者依据检查方案规定的内容进行检查,必要时开展全面检查。”这条规定对“日常检查”进行了明确的说明,也就是可以针对部分环节或依据检查方案进行的非全面检查。
本文件7.3.1-7.3.3条款,结合前期试点工作的经验,针对药品、医疗器械和化妆品专业特点、日常检查范围梳理出日常检查要点,形成了14个日常检查要点表(具体见标准的附录B、附录C、附录D和附录E),分别涉及原料药生产、药品制剂生产、医疗机构制剂配制、医用氧气生产、中药饮片生产、药品批发、药品零售连锁、特殊药品经营、疫苗配送、医疗器械生产、化妆品生产、化妆品注册人/备案人以及网络交易第三方平台,与本文件规定的第4章“检查范围”相对应。这使日常检查更有针对性,使用检查内容更加聚焦,同时也可反作用于日常检查信息系统的更新与改进,是落实国家要求的重要体现。需要说明的是,《直接接触药品的包装材料和容器管理办法》(国家食品药品监督管理局〔2004〕13号)已废止,《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告》(国家药监局〔2019〕56号)对原料药、药用辅料、药包材的检查实行管理规定,强调“原料药、药用辅料、药包材的使用必须符合药用要求,质量安全及功能应该满足药品制剂的需要。”因而现阶段在检查执行层面药用辅料、药包材参照原料药日常检查要点表。由于我省中药提取物生产企业为数不多,故未针对其专门编制检查要点表,参照药品制剂日常检查要点表。
日常检查受检查时间所限,现场重点关注法规符合性,但是也需兼顾规范符合性。因而,当发现检查要点以外的重要问题时,也应作为缺陷项进行记录。现场日常检查要点表为药械化企业的日常检查提供了清晰的标准化操作要求,有助于提升监管效率和检查质量,使日常检查工作符合实际情况,更具操作性和实效性。
(3)7.3.4-7.3.12条款不仅规定了检查组现场实施检查时在取证、记录、违法查处、检查纪律、关注要点等方面的要求,也明确了检查过程中被检查单位的配合义务。
(4)7.3.13条款强调检查组必须根据现场检查情况客观、公平、公正地评价,并形成现场检查结论。
3.现场检查后
现场检查后工作主要包括跟踪检查与处置、信息上传与反馈以及材料归档三个主要内容。重点体现了监管闭环,从有效实施能提升检查实效。主要技术要求如下:
(1)第8章主要依据药械化法规、《药品检查管理办法(试行)》,参考《山东省药品监督管理局药品经营监督检查后处置工作程序》(鲁药监规〔2023〕5号)提出,涉及现场检查后对企业各阶段进行的整改情况的跟踪检查、综合评定以及所采取的后处置措施等。
根据《药品检查管理办法(试行)》的规定,现场检查结论为“待整改后评定”的,需对企业整改的情况复查后再进行综合评定,整改合格的综合评定结果为“符合要求”,反之“不符合要求”;现场检查结论为“符合要求”或“不符合要求”的应直接进行综合评定,综合评定结论相应的为“符合要求”或“不符合要求”。现场检查结论为“符合要求”的包括“符合无缺陷项”和“符合但存在轻微缺陷项”两种情形,存在轻微缺陷项的企业也需整改,且需经检查派出单位复查。综合评定结论为“不符合要求”的,或复查后确认整改不合格的,应视具体情节采取限期整改、告诫、约谈、暂停生产销售、依法查处等后处置措施。
(2)第9章和第10章规定了日常检查结果的上报与材料归档要求,明确了上传检查系统的信息内容以及归档材料的内容。
相关推荐
CIO提供以下相关文库下载、合规服务以及线上培训课程学习。























