
药品中试车间GMP符合性审计
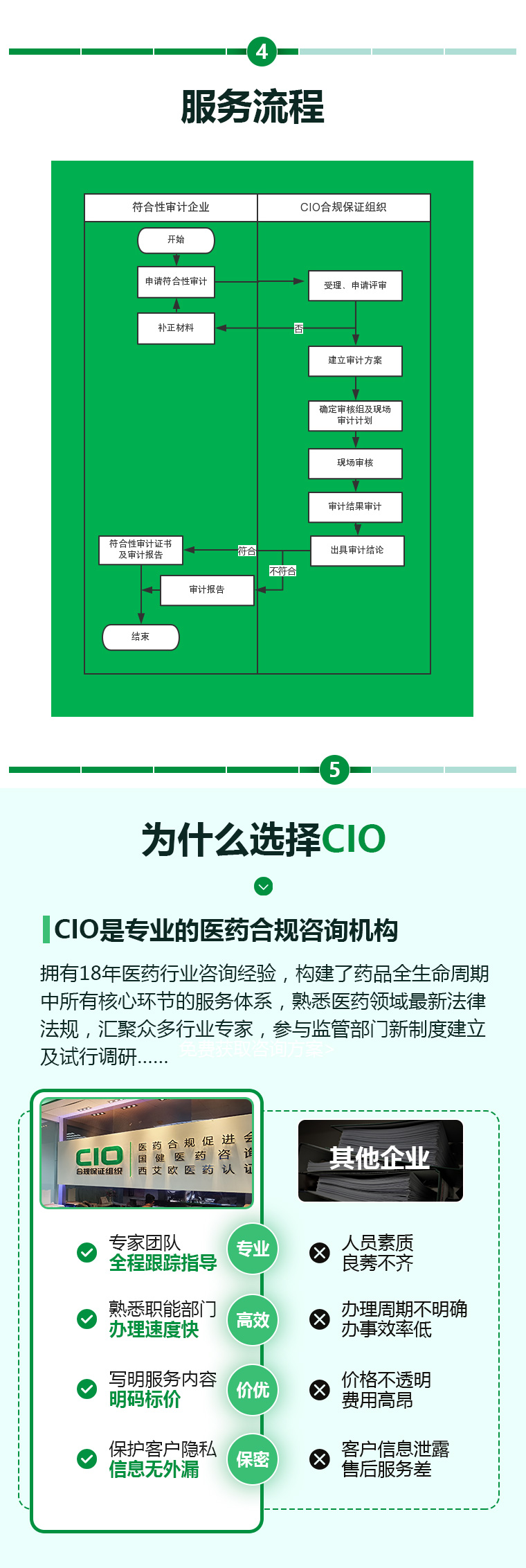
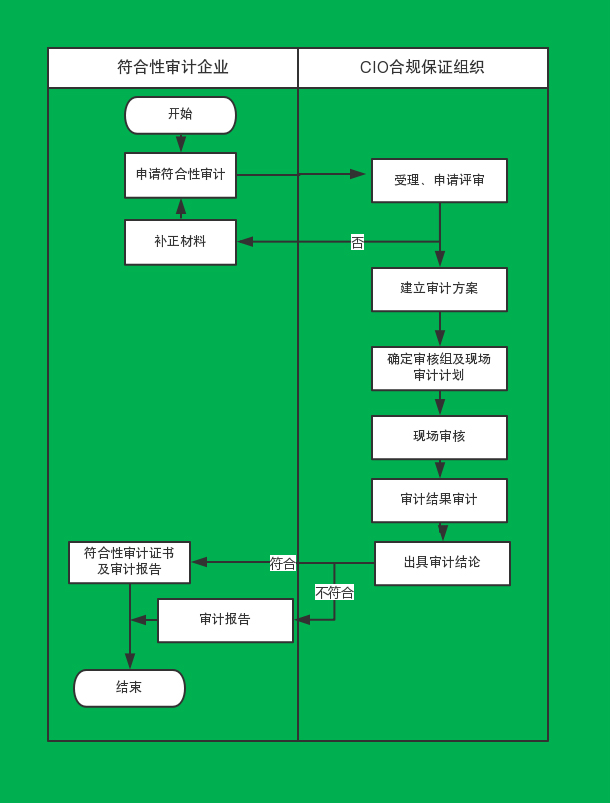
1.接受研发机构或制药企业申请,CIO合规保证组织作为独立第三方,审核药品中试车间是否符合GMP规范。 2.为符合规范的车间颁发符合性审计证书。 3.并每年对该车间进行持续监督审核。
参考价格 ¥0.00 ¥0.00

药品中试车间GMP符合性审计产品概述
接受研发机构或制药企业申请,CIO合规保证组织作为独立第三方,审核药品中试车间是否符合GMP规范,为符合规范的车间颁发符合性审计证书,并每年对该车间进行持续监督审核。
为什么要进行药品中试车间GMP符合性审计
1、只有在符合GMP的车间生产的产品才有质量保证,质量保证不仅是上市的安全性问题,也是保证中试数据重现性和可靠性。
2、法规要求临床样品必须在符合GMP的条件下生产。
3、临床机构要求证明临床样品是在符合GMP条件的生产车间生产。
药品中试车间GMP符合性审计服务流程
药品中试车间GMP符合性审计审核内容
CIO按照审计程序要求,依据《药品生产质量管理规范》(2010年修订)对被审核企业申请范围、场所实施现场审计审核。
药品中试车间GMP符合性审计客户案例
广州普维君健药业有限公司中试车间审计
广州博济生物医药科技园有限公司中试车间审计
深圳市健翔生物制药有限公司中试车间审计中试车间审计
分享









