接轨国际,药典委拟发布分析用天平与称量新规,提升药品检测精准度!
CIO专家-山丹
目前,《中国药典》在天平性能方面的要求尚属空白,其关于称量操作的规定也相对简化,相较于国际主要国家和地区的药典标准存在明显差距。为了提升标准的科学性、合理性和国际接轨程度,国家药典委员会于2024年5月6日在官网发布了《关于分析用天平与称量指导原则标准草案的公示》,这一举措旨在向国际先进标准看齐,公示期自发布之日起为期3个月,引起了行业内外的广泛关注。本文旨在对该《分析用天平与称量指导原则》进行快速解读,并提炼出其中的关键要点,以期为相关从业人员提供参考。
一、《分析用天平与称量指导原则》抢先看
称量是药品质量分析实验中的核心步骤,其准确性直接关系到药品的质量。电子分析天平,作为制药行业中不可或缺的计量工具,广泛应用于药品的研制、生产和质量控制环节。其快速且精确的称量特性为药品质量的保障提供了重要支撑。
为确保电子分析天平的称量结果准确无误,必须实施一系列严谨的操作流程,包括天平的确认、校准、期间核查、日常校准以及维护等。中国药典委组织制定了《分析用天平与称量指导原则》,对多个国家和地区药典中与称量和天平相关的内容进行了梳理与对比研究,同时参考了电子天平检定规程、电子天平校准规范、药品生产质量管理规范等技术文件,力求做到立足药品检验行业特色、与世界先进技术要求接轨,同时也符合我国现阶段国情,使技术要求便于操作。
1. 章节结构简介
《分析用天平与称量指导原则》的章节结构清晰简洁,主要涵盖三大核心部分。首先,针对仪器性能确认进行了详尽阐述,确保天平的准确性和可靠性;其次,详细介绍了天平的安装、使用和维护流程,以保障其正常运行和延长使用寿命;最后,制定了严格的称量规范,确保称量操作的准确性和一致性。整体而言,这部指导原则旨在提供一套系统、全面的天平使用和管理方案,以满足药品质量分析的高标准需求,章节内容示例如下表:

2. 分析用电子天平分类类型
天平按照原理主要可划分为机械天平和电子天平两大类。在药物分析实验中,电子天平因其高精度和便捷性而广泛应用。电子天平按照其实际分度值d(或称可读性)的不同,可以进一步细分为精密电子天平和分析级电子天平。
本《分析用天平与称量指导原则》专注于药典药品质量分析实验中使用的电子天平及其称量操作。当药典规定需进行“精密称定”时,首先应确保满足药典凡例下关于精确度的基本要求。在此基础上,可参照本指导原则中关于“灵敏度”和“重复性”性能核查的具体要求,选择性能合适的电子天平来执行“精密称定”操作,以确保称量结果的准确性和可靠性。
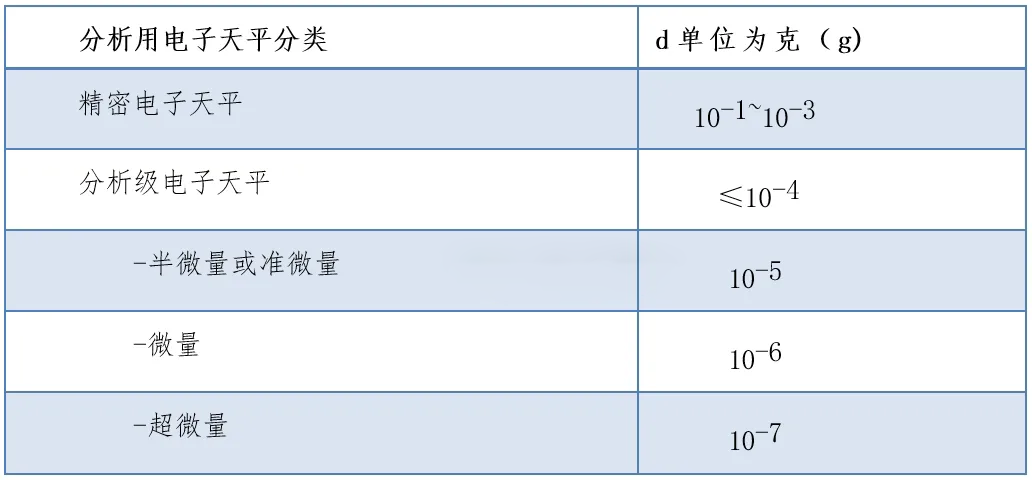
笔者对照了一下《分析用天平与称量指导原则》,发现本次分析用电子天平的分类,参照了根据《欧洲药典》第2.1.7章定义的天平类型,原文如下:

3. 分析用电子天平性能核查
在实验室的众多操作中,称量是至关重要的一环,其准确性直接影响到实验结果的可靠性。为了得到精确且可靠的称重结果,天平的性能确认显得尤为重要。USP(美国药典)在其第<1251>章中特别强调了“在分析天平上称重”的重要性,并提供了关于电子天平确认和操作的详细指导。根据这一指导,为确保称量的准确性,建议对天平进行“性能确认”测试。同样,中国药典委员会发布的《分析用天平与称量指导原则》也明确建议,在评估天平性能时,应至少进行以下三项性能测试:
(1)准确度
电子天平的准确度是衡量其测试结果与真实值接近程度的指标,主要受灵敏度、偏载误差和线性误差影响。其中,灵敏度对准确度的影响最为显著,尤其在最大称量值附近。性能核查时,主要考察灵敏度,可使用5%~100%最大称量值的砝码置零后称量,并计算示值与砝码质量的偏差,以验证是否满足准确度要求。在评估时,需确保砝码的误差在限度值内,以确保评估的准确性。
(2)重复性
在日常使用中,由于待测物的净重远低于电子天平的最大载荷,其性能主要受到随机误差的影响。为了评估随机误差,可以测定电子天平的重复性。测试时,使用标称质量不超过天平最大称量值5%的单一砝码(或100mg砝码,若前者小于此值),将天平置零后重复称量至少10次,并记录示值,计算标准偏差以确定重复性误差,从而评估电子天平的随机误差。
(3)最小准确称量值和最小样品量
最小准确称量值(msnw)是在满足电子天平重复性测定标准下,可称量的最小样品净重量,不包括称量容器皮重。它是一个随标准偏差变化的计算值,并受仪器状态、环境条件和操作人员影响。为提高称重可靠性,实验室可引入安全系数(SF)并设定最小样品量(mmin),建议的安全系数不小于1,确保实际称量的最小样品量不小于电子天平的最小准确称量值。
参考来源:
1. www.chp.org.cn中国药典委员会官网.
*本文来源 - - 智药公会微信公众号
相关文件下载、服务及学习课程:
合规文库:药品生产质量管理规范(2010年修订)
合规培训:药品GMP自检法规及要点解析
委托定制:GMP合规审计(符合性检查)
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点。本文为转载文章,版权归原作者所有,如涉侵权,请联系我们删除。
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






