概念验证(POC)-WHY,WHAT,HOW
CIO专家-山丹
概念验证(Proof of concept)is产品组合管理重要的节点,无论是自研项目的决策,还是license in项目评估,POC评估是重要的一步。本文回答POC的三个问题:WHY?WHAT?HOW?
WHY?
新药临床开发的成功率很低,以II期临床研究失败率最高。肿瘤和非肿瘤药物临床开发成功率I期到II期分别为62.8%和63.5%;II期到III期分别为24.6%和34.3%;III期到NDA/BLA为40.1%和63.7%;NDA/BLA到批准为82.4%和85.9%;整体从I期到批准为5.1%和11.9%。辉瑞2010-2019年间新分子实体II期临床研究失败的原因主要为疗效原因(57%),其次是退出治疗领域(18%),价值考量(13%),安全性问题(12%)。
早期临床试验失败的原因很多,包括候选药物未能与人类的靶点相结合;药物虽与靶点结合却没有发挥与目标疾病相关的临床效应;脱靶效应严重;药物虽与靶点结合但下游的生化路径并未发生作用; 多种代偿途径掩盖了候选药物相关的效应;不可预见的安全性问题;选择不合适的患者人群参加临床试验; 选择无法反应药物真实临床有效性的终点指标;剂量或给药方案选择不正确; 其他原因,如存在知识产权问题,在失败的产品组合上还花费过多资金等。早期临床需要回答的问题,是否选择了Right target?Right drug?Right patients?Right endpoints?Right dose?
企业在早期研发阶段做好Go或No go的决策非常重要,以便把最多的资源放到最具有blockbuster潜力的分子上,而未达成概念验证(Proof of Concept, POC)的分子及时终止。
WHAT?
在介绍POC之前,首先介绍药物作用的过程,包括药代动力学及药效学。首先是药物在体内分布,与靶点结合(机制验证 proof of mechanism), 然后发挥药效(概念验证)。见下图:
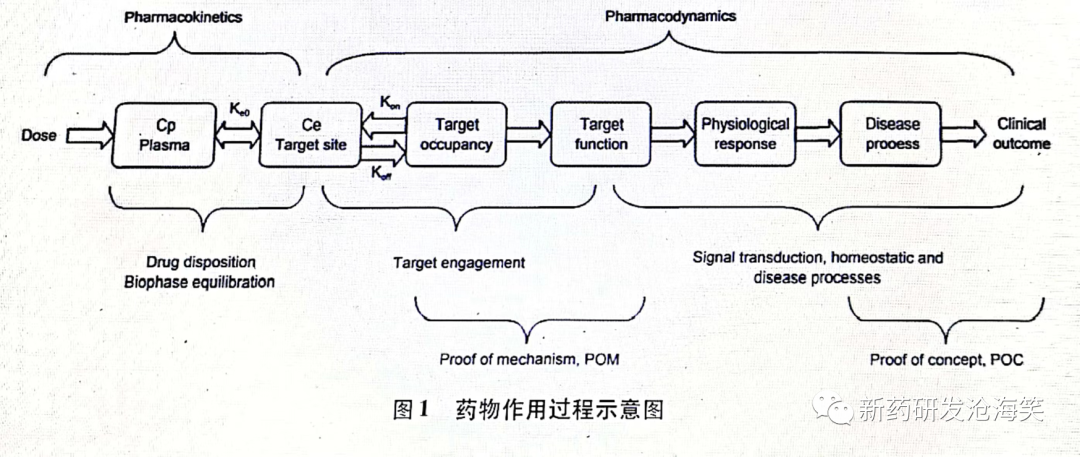
机制验证是药物的药理效应可以安全地在人体表达。从体外模型、动物模型观察到的药理效应,不一定能在人体中能够安全地实现。这是由于 1)模型因素:所建立的模型存在种属差异,动物结果预测性差,非常常见。 2)分布因素:在作用靶位处,体外或动物试验所显示的活性成分能达到的暴露和驻留时间,在人体可以耐受的剂量下不一定能够达到。POM通常在I期健康受试者SAD和MAD研究完成。
PhRMA(美国药品研究及制造商协会)对POC的定义为:POC is the earliest point in the drug development process at which the weight of evidence suggests that it is “reasonably likely” that the key attributes for success are present and the key causes of failure are absent.POC是药物研发过程中的最早表明药物具备成药的关键属性,而无关键失败的原因的节点。POC还被定义为药理效应可以转换成临床方面的患者获益。
探索性研究计划需包含满足POC的关键要素,如初步的有效性、药代动力学/药效动力学、安全性、剂型、商业和监管考量(见下表)。不同情况具有不同的考量。当考虑已上市药物更新配方或给药方案,如将给药方案从每天三次改为每天一次。从过去完成的研究结果来看,大部分指标都已经满足,除药代动力学(PK)外,还需证明新配方未引入新的成分从而导致风险升高。如果是me too或me better, 靶点已经过充分研究, 那么新分子的开发将侧重于差异化。全新类药物需要更多的POC关键要素,需要更多令人信服安全性和有效性的证据。如果是新的疾病,那么定义新疾病需要监管机构认可研究终点以及注册可行性高方可,探索性开发计划尽可能多探索满足POC的关键要素。

POC的设计及设施需要一系列的工具, 包括1)生物标志物;选择好患者人群;PK/PD建模辅助剂量选择;临床试验模拟;适应性设计等。2)生物标志物的选择需要回答几个问题:是否与人体的靶点相结合?是否在人体上表现出了预期的PD?该药在人类身上的PK和PD呈现什么关系?早期患者研究中的剂量/浓度是否适合进一步探索该药物的有效性?剂量范围是否在人体可耐受?在人体是否有脱靶毒性的信号?脱靶效应是否在其他类似的药物中发生?脱靶效应在动物模型中是否存在?在人类的体外研究中是否存在脱靶效应?脱靶效应的PK/PD关系如何?
MNC达成POC的分子中40%终止开发,10%暂停(on hold), 50%继续开发。临床前安全性研究开始到POC结果read out的时间中位数为36个月。肿瘤研究的POC达成率高,但注册成功率低(8-12% vs 20%心血管药物), 显示肿瘤药物的假阳性POC决策效率低于其他适应症。1/3的POC在I期研究中完成,2/3在II期完成,III期极少。通常来说,小分子药物的POC成功率低于大分子生物药,但整体注册成功率两者相当,意味着大分子的III期失败率高于小分子。
How?
POC研究设计通常分为两种,第一种设计是MTD组+安慰剂组设计。第二种是将POC和dose ranging研究设计在一起。第一种设计简单而清晰,目的只有一个:POC是否可以达成。如果在MTD下,观察不到TPP中预设的标准,或者无显著区分,那么NO GO。如果观察到符合一定标准的药效学信号,其他方面如符合TPP的标准,那么GO。这种设计的前提是:1)I期研究估计的MTD是准确的,因为如果MTD过大,那么会给后期的研究带来风险;如果过低,那么疗效不佳,POC无法达成;2)疗效跟剂量呈单调递增趋势。如果不呈递增趋势,甚至是疗效与剂量呈U型,那么这种设计不可行。
第二种设计是POC+dose ranging, 它的优点是仅一个研究,便可满足两个目的:POC是否达成以及对量效关系进行探索。POC的设计分为两种: 1)选择最大剂量组与安慰剂组的疗效进行比较。或者 2)使用MCP(Multiple comparison procedure)选择至少一个有效剂量,如果任意剂量的疗效优于安慰剂,则POC达成。
在开展POC 试验时,首先是选择合适的疾患者群,由于候选化合物是基于分子靶位筛选而来,入选的患者应该具有这些分子靶位。第二,疗效终点的选择一般要求该指标变异度低( 可以入选少量患者) 、反应迅速( 如≤4周)。此外,样本量估算从以下几个方面考量:1).选择Delta-treatment difference, “有临床意义”的;2)选择alpha(type I error): 监管风险,通常为0.05(one or two sided);3). 选择beta (type II error): 申请人风险,非监管要求,III期临床通常设为≤20% (把握度80%或以上)。. 但II期临床研究的alpha和beta更为灵活:One sided alpha: 0.0125,0.025,及0.05也常见,beta:>0.2少见,但beta值为0.15,0.1甚至0.05也不少见。
POC研究的结果会有不确定性,需做好计划及准备。统计相关的问题见下表:

非统计相关的问题如下:

案例分析:
1)西格列汀的POC-加速临床开发进程
POM:在西格列汀的I 期健康人群进行的临床试验中,耐受性、PK 和多个PD 指标的研究是同时进行的。通过给药后检测DPP-IV 酶的抑制情况、餐后活性GLP-1 的浓度,对西格列汀的作用机制进行了验证( POM 阳性) ;
POC:在I 期健康人中通过OGTT( 口服糖耐量试验) 试验,观察试验中的血糖下降、胰岛素的分泌情况、胰高血糖素的变化情况,对西格列汀进行了概念验证( POC 阳性) 。
给药剂量预测:在I 期中完成了单次和多次给药的PK/PD 研究,获得的研究结果与临床前动物实验中获得的酶抑制阈值进行比较,非常成功地对给药剂量进行了预测。
结果:由于在I 期阶段就完成了POC 研究并获得了阳性结果,除了增加试验成功的把握度外,还省去了IIa 期的研究,临床开发时间减少了1.5 年。
2)瑞莎珠单抗新增强直性脊柱炎适应症的POC-NO GO
莎珠单抗的生命周期管理,为何考虑强直性脊柱炎?1)从患者或疾病角度,强直性脊柱炎 (AS) 是一种慢性炎症性风湿性疾病,主要影响轴向骨骼,进行性结构和功能障碍。如果不经过及时正规的治疗,可能导致严重的骨质破坏,硬化和骨质疏松,关节完全强直,患者丧失活动能力和残疾,给患者带来巨大的痛苦和家庭负担。2)临床上未满足需求大。AS 通常对传统的改善疾病的抗风湿药药物(DMARDs)和AS的全身治疗由非甾体抗炎药组成(NSAIDs)、肿瘤坏死因子抑制剂反应不佳。3)从生物学层面,已有证据表明 IL-23 是潜在的治疗AS的靶点。病例对照全基因组关联研究GWAS已证明 IL-23 受体 (IL-23R)基因多态性与增加AS的风险。此外, IL-23RR381Q 基因突变具有保护作用。AS患者关节中也发现产生 IL-23 的细胞数量增加,而AS患者血液终点 IL-23 反应Th22、Th17 和 gamma/delta T细胞数量增加。刺激从 AS 患者中分离出来的的外周血单核细胞增加IL-23 的产生。小鼠AS模型显示IL-23 通路对驱动附着点炎症和骨形成发挥重要作用。IL-23 是诱导和维持Th17细胞作用的重要细胞因子。4)下游机制分子在此适应症已批准:IL-17A 抑制剂苏金单抗已被批准用于治疗 AS,作为IL-17信号通路的上游分子,从机制上也支持抑制IL-23对AS患者有益。因此,从未满足需求,生物学层面,以及下游分子获得该适应症的批准角度而言,开发此适应症是合理的。
基于已完成的机制验证、前期的临床前数据、以及商业化考量,申办方开展了一项在强直性脊柱炎患者中的概念验证(POC)和剂量探索(dose finding)的II期临床研究。该研究在北美、欧洲和东南亚地区开展。该研究入组159例未经生物药治疗的活动性强直性脊柱炎患者(Bath Ankylosing Spondylitis Disease Activity Index score (BASDAI≥4),1:1:1:1随机接受瑞莎珠单抗18mg,90mg, 180mg 和安慰剂治疗,在0周,8周,16周和24周接受给药。首要终点是12周时达成ASAS40的患者比例。研究设计如下:
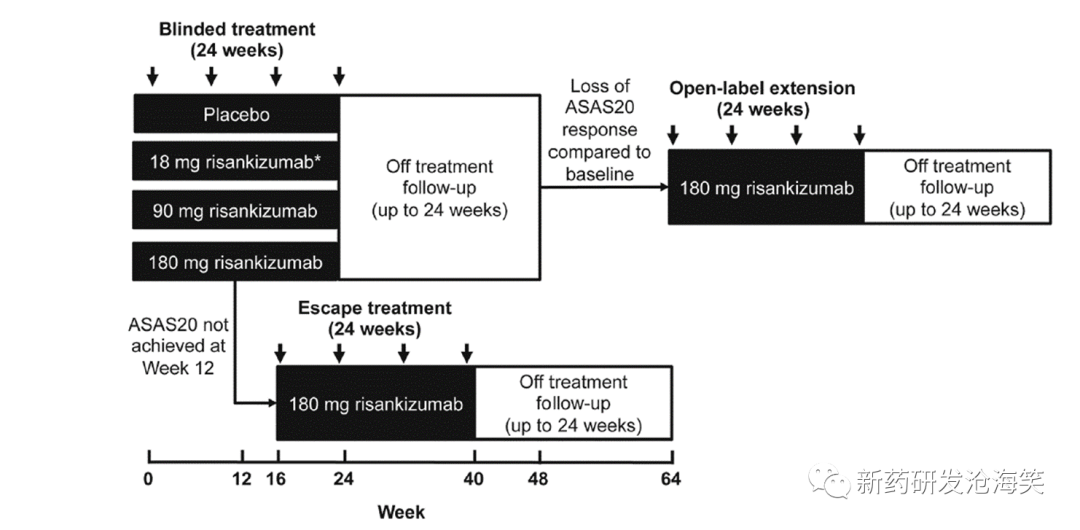
POC未达成的原因分析:
1)瑞莎珠可能没有完全抑制所有产生 IL-17 的路径。临床前研究证明,虽然IL23已被较充分地证明其在诱导和维持 Th17细胞功能的作用中,非IL-23 依赖性来源的 IL-17 仍可能活跃地存在,例如分泌 IL-17 的肥大细胞和黏膜相关的永久性T细胞。
2) IL-23 和IL-17 之间不是线性的。在体内自身免疫小鼠模型显示,IL-17 和 IL-23 的双重抑制缓解疾病比单一细胞因子更有效,证实了 IL-23 和IL-17 之间不是线性的。
3)IL-17 和 IL-23 的不一致作用在克罗恩病中也观察到。IL-17抑制剂对克罗恩病的无临床疗效,甚至导致疾病的恶化和炎症标志物升高(包括血清CRP和粪便钙卫蛋白),而IL-23 抑制对克罗恩病却是有效的。
由此可见,IL-23虽然处在IL-17的上游,但两者在同疾病的生物学上发挥的作用是不完全相同的。这些证据至少可以部分解释在银屑病上可以发挥较好的治疗作用,而在强直性脊柱炎和克罗恩病上,它们的作用却又不同了。
总结
POC存在着较大的挑战,POC方面的专家或资深人士较少,POC设计多学科,需要公司内部相关人员加强合作,甚至行业间的合作,以减少不确定性。企业在早期研发阶段做好Go或No go的决策非常重要,以便把更多的资源放到最具有blockbuster潜力的分子上,而未达成概念验证(Proof of Concept, POC)的分子及时终止。
*本文转载自微信公众号 - - 新药研发沧海笑
相关文件下载、服务及学习课程:
合规培训:AAV基因治疗产品CMC开发的合规实践
委托定制:药品生产许可证办理
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






