浅谈清洁验证的实施
CIO专家-文竹
1. 背景介绍
《药品生产质量管理规范》(GMP)第一百四十三条规定,清洁方法应当经过验证,证实其清洁的效果,以有效防止污染和交叉污染。清洁验证应当综合考虑设备使用情况、所使用的清洁剂和消毒剂、取样方法和位置以及相应的取样回收率、残留物的性质和限度、残留物检验方法的灵敏度等因素。
清洁验证必须有文件和记录,通常包括清洁验证风险评估报告以及清洁验证方案,验证过程和数据记录在验证方案中,方案执行完毕后,编写清洁验证总结报告中。
首先制定《XXX生产线清洁验证风险评估报告》和清洁验证方案,一般在产品工艺验证时同步进行生产线的清洁验证,并评价生产线设备/器具现有清洗程序的可靠性,降低污染与交叉污染的风险,确保产品质量。为了保证结果的重现性和准确性,必须连续进行3次成功的清洁验证。如果实际的结果不符合可接受标准,进行偏差处理,并形成偏差报告。本文以成品生产线清洁验证阐述如何开展清洁验证。
2. 清洁验证范围评估
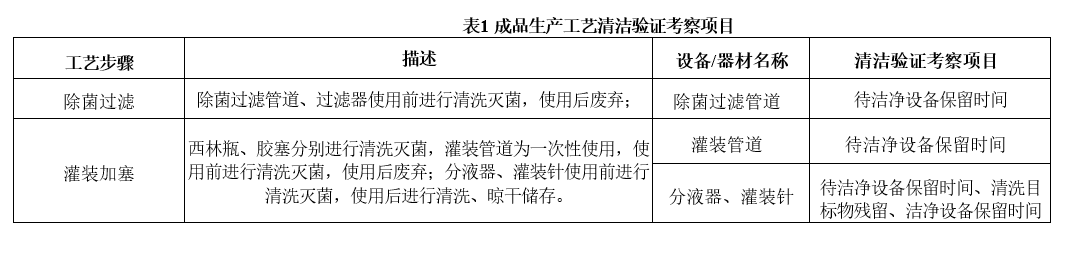
依据成品生产工艺以及每步工艺涉及到的生产设备/器材清洁验证范围进行评估,确定各设备、器材清洁验证的考察项目:
➢ 待清洁设备保留时间:设备使用后至开始清洁时间不超过24h。本次验证时设备放置超过24h后再进行清洗,考察待清洁设备保留时间的合理性。
➢ 清洗目标物残留:选择清洗目标物,计算最低允许残留限度,对设备/器具的清洗流程合理性及清洗效果考察。
➢ 洁净设备保留时间:对设备/器具清洗后的洁净设备保留时间考察,用微生物负荷指标评价洁净设备保留时间的合理性。
3. 清洗目标物选择评估
(1) 活性成分(首要考虑条件)
药品一般由活性成分和辅料组成,通常相对于辅料,需要更关心活性成分的残留,因为活性成分可能直接影响下批产品的质量、疗效和安全性,所以活性成分残留必须作为清洁验证的合格标准之一。当存在两个以上的活性成分时,其中最难溶解的成分即可作为最难清洁物质。
(2) 溶解度
清洗目标物的溶解度与清洗效果直接相关,物质在清洗剂中的溶解性越好,清洗时残留物越易清洗干净,故清洗目标物选择时需考虑物质的溶解性。溶解度评分标准:极易溶解1分,易溶2分,溶解3分,略溶4分,微溶5分,极易溶解6分,几乎不溶7分。
(3) 毒性
清洗目标物毒性与药品安全性直接相关,毒性越大,清洗时越需关注清洗后残留,确保药品的安全性。毒性评分标准:微毒(致死量15 g/kg)1分,低毒(致死量5-15 g/kg)2分,中等毒(致死量0.5-5 g/kg)3分,高毒(致死量50-500 mg/kg)4分,剧毒(致死量少于5 mg/kg)5分。
(4) 成分浓度
物料成分浓度越大,设备内表接触的单位面积残留物越多,清洗难度增加。物料成分浓度评分标准:<10 mg/L 0.5分,10-100 mg/L 1.0分,100-1000 mg/L 1.5分,1-10 g/L 2.0分,>10 g/L 2.5分。
基于以上四方面,采用风险指数评估法,对成品生产线各设备/器具清洗目标物进行评估。如果设备、器材接触的物质包含活性成分,则活性成分为清洁验证考察的清洗目标物,其他成分不再进行评估,对成品生产线清洁验证范围内的设备/器具清洗目标物评估,评估结果见表2: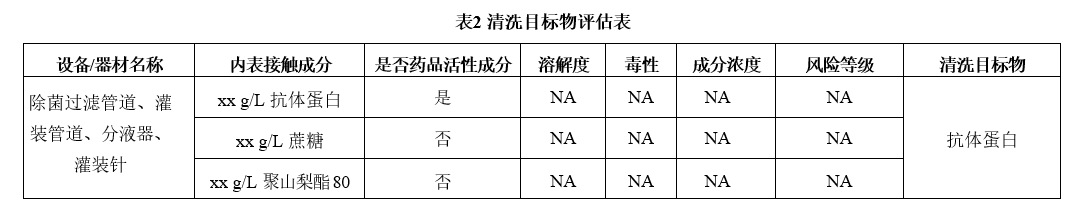
4. 清洁验证可接受标准
清洁验证评估方法包括目检和取样检测,取样检测可选择淋洗液法和擦拭法,首选擦拭取样法,可考察最难清洁部位的清洗目标物残留,对于难以擦拭取样的(如硅胶管或滤芯等),可采用淋洗水取样。
4.1. 目检可接受标准
在清洗完后,首先对设备/器具内表目检,不得有肉眼可见的残留物。由于设备内表面抛光良好,目检能发现≥ 4 μg/cm2 的残留。
4.2. 化学残留可接受标准
(1) 除菌过滤管道和灌装管道
除菌过滤管道和灌装管道为一次性使用,使用后即废弃,所以不需考虑化学残留。
(2) 分液器和灌针
➢ 采用化学浓度限度(10 ppm)法:即上一批次清洗目标物残留在下一批次中的残留物数量应不超过下一批批量的十万分之一(10 ppm)。设下一批次批量为 A(kg),则残留物浓度最高为 10×10 -6 即 10 mg/kg,则残留物总量下限值为 A×10×10 -6=10 A(mg);假设分液器和灌针内表面积为B cm2,计算单位面积擦拭残留量10 A/B mg/ cm2,25 cm2擦拭残留量的可接受标准为 250 A/B mg。
➢ 淋洗液限度:残留总量为10 A(mg),用 2L 注射用水进行淋洗取样,淋洗水残留的浓度限度为 5Amg/L,目标产品碳含量为 C%,折算 TOC 值=5A×C%ppm=0.05 AC ppm,如果数值高于注射用水 TOC 0.5 ppm 的标准,以注射用水 TOC 标准作为灌装器材淋洗法取样可接受残留标准。
➢ 棉签擦拭限度:擦拭残留量的可接受标准为 250 A/B mg,棉签擦拭后用 45 mLTOC 检查用水润洗棉签,擦拭残留的浓度限度为5.56 A/B mg/L,目标产品碳含量为C%,折算 TOC 值=5.56 A/B×C%ppm=0.06 AC/B ppm,如果数值高于注射用水 TOC 0.5 ppm 的标准,以注射用水 TOC 标准作为灌装器材棉签擦拭可接受残留标准。
4.3. 微生物限度可接受标准
取样按注射用水微生物限度标准(≤10 CFU/100 mL)考察。
4.4. 细菌内毒素残留
按注射用水标准(<0.25 EU/mL)检测细菌内毒素残留。
5. 清洁验证考察项目汇总
综合以上描述,同时根据设备擦拭部位评估,对成品生产线清洁验证考察项目汇总,见表3.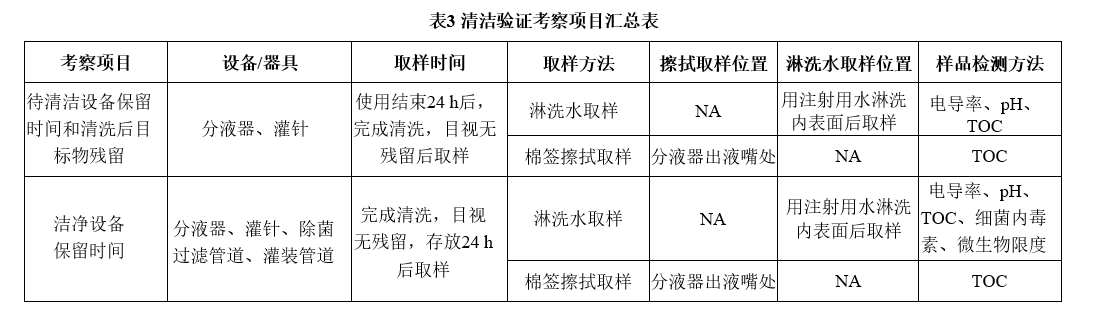
6. 取样程序
6.1 活性成分残留取样程序
➢ 棉签法取样:棉签蘸少量润洗溶液(如0.1 mol/L氢氧化钠溶液),擦拭取样范围为25 cm2,首先横向擦拭,然后翻转棉签再纵向擦拭,注意棉签沿一个方向擦拭,不允许来回擦拭。注意对于设备内部擦拭面积不足25 cm2时需计算实际擦拭面积。擦完后棉签放入TOC检测瓶中,加入45 mLTOC检查用水浸泡40 min以上,用TOC仪检测。
➢ 淋洗水取样:取最后一次淋洗水,或清洁结束后用适量的注射用水淋洗设备/器材内部,接取淋洗水。
6.2 微生物/内毒素取样程序
用规定量的注射用水淋洗设备内部,接取淋洗水。
6.3 样品编号原则
对于擦拭棉签样品、淋洗水样品、微生物样品,按照正常工艺流程,对各个取样点进行编号。
7. 验证方案
7.1 洁净设备保留时间验证
确认分装器具按照清洗SOP 清洗和存放后,内表面残留物限度是否符合可接受标准。
7.1.1 方案
➢ 除菌过滤管道、分液器、灌装针、灌装管道使用前,按照清洗操作规程完成清洗,清洗后目视检查无残留。
➢ 淋洗液取样:将除菌过滤管道、分液器、灌装针、灌装管道连接,用注射用水淋洗,取淋洗液检测 pH、电导率、 TOC、细菌内毒素、微生物限度。
➢ 化学残留擦拭取样:用 0.1 mol/L 的 NaOH 溶液润湿棉签,对分液器内部出液嘴焊接处进行擦拭取样,擦拭面积约 25 cm2。
➢ 取样完成后,沥干器具内表面水分,包扎后存放24 h 后,按照7.1.1方法对器具内表面进行取样,重复进行 3 次。
➢ 注意事项:取样按照编号规则标注样品,避免混肴;棉签擦拭后,用TOC检查用水浸泡棉签40 min 以上,检测TOC总;清洁验证棉签擦拭时,清洗目标物残留TOC残留=TOC总-TOC擦拭空白,TOC擦拭空白为棉签+TOC 瓶+TOC检查用水的总TOC值。
7.1.2 可接受标准
淋洗液 pH、电导率按照工艺要求的标准,TOC标准按照4.2化学残留可接受标准,细菌内毒素、微生物限按照注射用水标准。
7.2 待清洁设备保留时间和清洗目标物残留验证
确认分装器具使用结束后按照清洗SOP清洗后,内表面残留物是否符合可接受标准。
7.2.1 方案
➢ 生产结束,将分液器、灌针放置24 h后按照器具清洗操作规程对器具进行清洗。
➢ 淋洗液取样:清洗后将分液器和灌针连接,用注射用水淋洗,取淋洗液检测pH、电导率、TOC。
➢ 化学残留擦拭取样:用 0.1 mol/L 的 NaOH 溶液润湿棉签,对分液器出液嘴焊接处进行擦拭取样,擦拭面积 25cm2。
➢ 注意事项:取样按照编号规则标注样品,避免混肴;棉签擦拭后,用TOC检查用水浸泡棉签40 min 以上,检测TOC总;清洁验证棉签擦拭时,清洗目标物残留TOC残留=TOC总-TOC擦拭空白,TOC擦拭空白为棉签+TOC 瓶+TOC检查用水的总TOC值。
7.2.2 可接受标准
淋洗液 pH、电导率按照工艺要求的标准,TOC标准按照4.2化学残留可接受标准。
8. 验证报告
在验证报告中汇总三批验证的结果,并进行科学的分析,确认实施过程和结果完全符合要求,无未解决的偏差存在,并得到最终的结论,确认该清洁方案被授权于XX项目成品生产的器具清洁。如不符合,必须重新选择合适的清洁方案。
CIO合规保证组织,为广大药企提供药品生产合规整体解决方案委托定制服务。点击下方链接,提交您的需求!
相关文件下载、服务及学习课程:
合规培训:工艺验证与工艺设计(上)
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点






















