纯B证企业如何搭建MAH体系?
CIO专家-三七
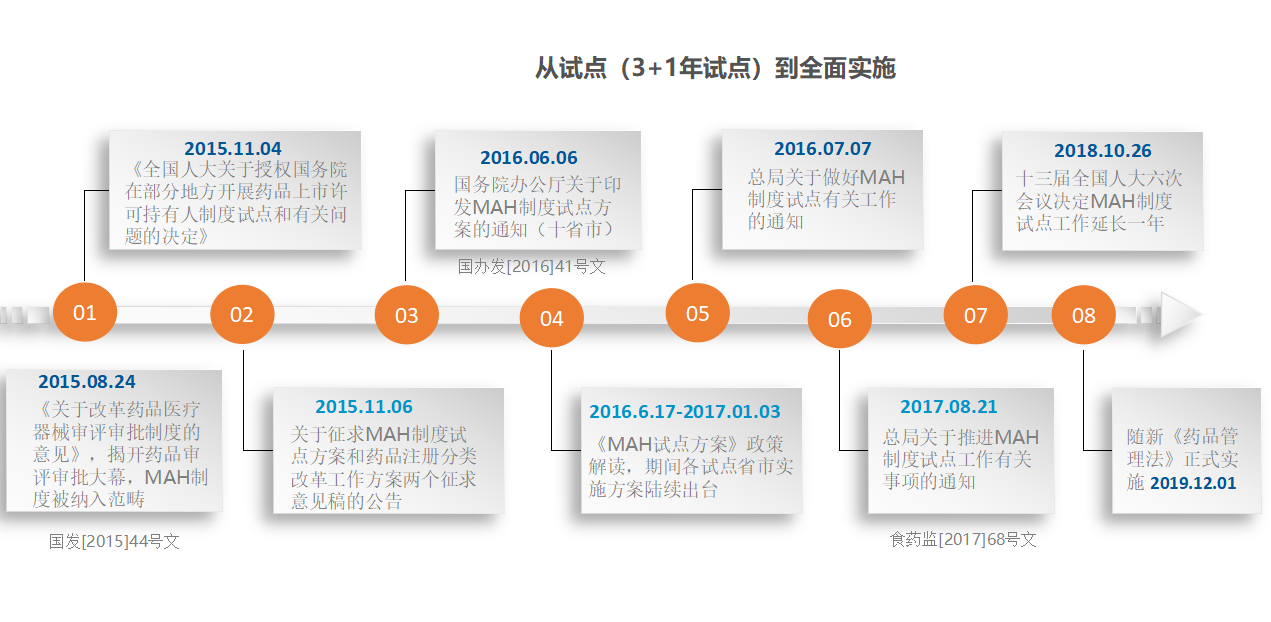
一、MAH制度在国内的发展?

二、B证企业现状
据不完全统计,截至2022年4月,我国现有药品生产许可证8781张,其中由MAH持有人获得的B证有1062张,其中新进B证企业502家,新进的B证企业主要包括:研发型企业持有、原料药企业持有、药品销售企业持有、业外投资企业持有,据统计发现,目前新进B证企业以药品销售企业居多。
三、纯B证企业如何搭建MAH体系?
1)组织架构
根据《药品上市许可持有人落实药品质量安全主体责任监督管理规定》要求,需配备五大关键岗位人员:①企业负责人(主要负责人)、②生产管理负责人(简称生产负责人)、③质量管理负责人(简称质量负责人)、④质量受权人、⑤药物警戒负责人,关键岗位人员资质需符合相关质量管理规范有关要求。
关注点:
①质量管理负责人和生产管理负责人不得互相兼任;
②一般质量负责人与质量受权人互相兼任;
③多数省份要求独立配备符合GVP规范资质要求的药物警戒负责人,接受符合资质要求的质量负责人或质量受权人兼任药物警戒负责人;
④企业负责人较以往增加“应当具备医药相关领域工作经验,熟悉药品监督管理相关法律法规和规章制度”要求,提高了企业负责人的任职要求;
⑤关键岗位人员应为全职人员。
2)具备三大能力要求
①质量管理能力
要求MAH必须建立一套药品全生命周期全过程的质量管理体系,并且配有相应技能的管理人才,保证质量管理体系的正常运行。
②风险防控能力
要求MAH具备风险识别、风险预警、风险消除、偏差处理的能力,做好全生命周期的药物警戒管理。
③责任赔偿能力
指MAH必须具备因为质量问题导致责任赔偿的能力,一般从三个方面获得支持,一个是资产保证,二是关联担保,三是保险机构承保。
关注点:随着MAH制度推行的深入,相关法规越趋完善,对于MAH制度暴露的不足监管趋严,对于新进B证企业的关键人员资质审查以及责任赔偿能力越趋关注,进一步提高了准入门槛。
3)MAH体系文件搭建
MAH需建立包括药品研发、生产质量、市场销售、药物警戒、产品召回和责任赔偿等全生命周期的质量管理体系,体系文件一般包括以下九个方面内容:
①机构与人员
②质量保证体系
③药物警戒管理
④上市后风险管理
⑤生产管理
⑥文件与记录管理
⑦责任赔偿
⑧追溯体系
⑨年度报告制度
4)CMO公司如何选择?
纯B证企业一般均需要委托他人生产,如何选择一家合适的CMO公司至关重要,以下讲述CMO公司筛选的八大关注点:
①企业持续经营的能力(如:企业资信情况)
②质量体系(合规性)(如:体系建设情况)
③生产能力(如:批量、设备产能情况)
④研发或技术转移能力
⑤成本及优化能力(如:时间成本、管理成本、质量成本)
⑥监管机构检查历史(如:通过国外认证情况)
⑦EHS能力(如:安全环保体系认证)
⑧地理位置(如:产品运输)
CMO公司筛选的一般流程:
遴选供应商(如:问卷调查)——潜在供应商现场考察——初步商业谈判——签订意向书后现场审计——合同签订/签署质量协议——技术转移——商业化生产——产品运输
四、MAH体系相关法规
由于MAH相关法规较多,在这里只列出国内MAH主要相关的法规:
①MAH政策法规
药品管理法(2019)
疫苗管理法(2019)
药品生产监督管理办法(2020)
国家药监局关于实施新修订《药品生产监督管理办法》有关事项的公告(2020年 第47号)
药品注册管理办法(2020)
国家药监局关于实施《药品注册管理办法》有关事宜的公告(2020年 第46号)
药品召回管理办法(2022)
药品年度报告管理规定(2022)
药品追溯码标识规范(2022)
药品追溯消费者查询结果显示规范(2022)
药品网络销售监督管理办法(2022)
药品上市许可持有人落实药品质量安全主体责任监督管理规定(2023)
中药注册专门管理规定(2023)
《药品生产场地管理文件指南(试行)》(2020征求意见稿)
药品管理法实施条例(2022修订草案征求意见稿)
药品上市许可持有人检查要点(2022征求意见稿)
境外药品上市许可持有人境内代理人管理暂行规定(2020试行的征求意见稿)
②MAH生产相关法规
药品生产质量管理规范GMP(2010)
药品委托生产质量协议指南(2020)
药品检查管理办法(2021试行)
药品GMP附录:临床试验用药品(2022试行)
药品共线生产质量管理指南(2023)
③临床相关法规
药物临床试验质量管理规范(2020)
药物临床试验期间方案变更技术指导原则(2022试行)
“临床风险管理计划”撰写指导原则(试行)(2021)
④上市后变更法规
药品上市后变更管理办法(试行)(2021)
已上市化学药品/中药/生物制品药学变更指导原则(2021)
已上市化学药品和生物制品临床变更技术指导原则(2022)
⑤药物警戒法规
药品上市许可持有人药物警戒年度报告撰写指南(试行)(2019)
上市药品临床安全性文献评价指导原则(试行) (2019)
药物警戒质量管理规范(2021)
药物警戒体系主文件撰写指南(2022)
药物警戒委托协议撰写指导原则(2020试行)
药物警戒检查指导原则(2022)
药品上市许可持有人MedDRA编码指南(2022)
已上市中药说明书安全信息项内容修订技术指导原则(试行) (2022)
以上为本期“纯B证企业如何搭建MAH体系”包含的内容。如果您有MAH方面的困扰或MAH外包服务需求,欢迎联系CIO在线咨询!
相关文件下载、服务及学习课程:
合规文库:MAH体系文件目录(2021版)(第一部分质量保证体系)
合规培训:药品生产品种转让之MAH变更
委托定制:MAH(药品上市许可持有人)申请
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点






















