关于中国药典里装(重)量差异检验法优劣问题的探讨(上)
CIO专家-九三(沙棘)
新药品管理法出台以来,对于产品在市场抽检不合格的涉事企业,均开出了价格不菲的罚单和随之而来的召回和相关批次产品的销毁等后继处理,这对本已处于集采的重压下企业来说,更是雪上加霜了。近期陆续看到一些省市的抽检质量公报,不合格项目多种多样,其中装(重)量差异不合格的也不在少数。那么我们今天来看一下,药典规定的这个检项优劣长短。
一、 中国药典规定[1]
装(重)量差异:以片剂为例:取供试品20片,精密称定总重量,求得平均片重后,再分别精密称定每片的重量,每片重量与平均片重比较(凡无含量测定的片剂或有标示片重的中药片剂,每片重量应与标示片重比较),按表中的规定,超出重量差异限度的不得多于2片,并不得有1片超出限度1倍。
表1 重量差异检查法的限度规定

从以上标准规定的内容中,我们可以得出以下信息:
1.一批片剂产品,无论批量是多少,是1千片、1万片、10万片或是100万片,判定该批药品“重量差异”项,是否符合规定,都只要抽20片即可;
2.标准规定了产品片重的规格限为20片的平均片重或标示片重的一个百分比范围,如0.30g以上是±5%,超出这个范围就不合格;
3.这20片中,如果有2片的重量超出以上范围,同时没有1片超出限度的1倍,则该批重量差异项合格;如果有多于2片,如3片或以上超出,或少于2片,但有1片超出限度1倍,则该批重量差异项不合格。这实际给出了一个抽样方案即L(20,2)(为讨论方便,后面我们讨论时,暂不将超出限度1倍的情况纳入讨论,因为此情况较L(20,2)更松,不会最终影响讨论结果)。
二、 药典抽样方案剖析
抽样检验是用来判断批质量水平(以不合格品率表示、用不合格品百分数度量),用以保护供需双方的利益,特别是顾客的利益。
现在中国药典规定的重量差异不是全数检验,而是通过抽样检查来判定批产品的重量是否符合中国药典的要求,药典给出的抽样方案是(n=20,Ac=2) ,是一个计数型一次抽样方案。同时抽样方案的操作特性曲线(OC曲线如下图),有效地反映了批质量水平与批被接收概率的关系,给定了使用方风险,就能找的它的风险质量(反之,给定使用方风险质量,亦可找到使用方风险!),等同采用ISO的国标GB/T(如:GB/T 2828.1-2012;GB/T 8054-2008……) 都规定使用方风险为10%(即批产品质量达不到要求时,因为抽样误差的存在,仍然有大约10%的不合格批次被当做合格批次接收)。我们知道这样的计数型抽样分布服从二项分布。据此,使用excel软件中的BINOMDIST(二项分布概率)函数,可做如下计算,见下表1和图一:
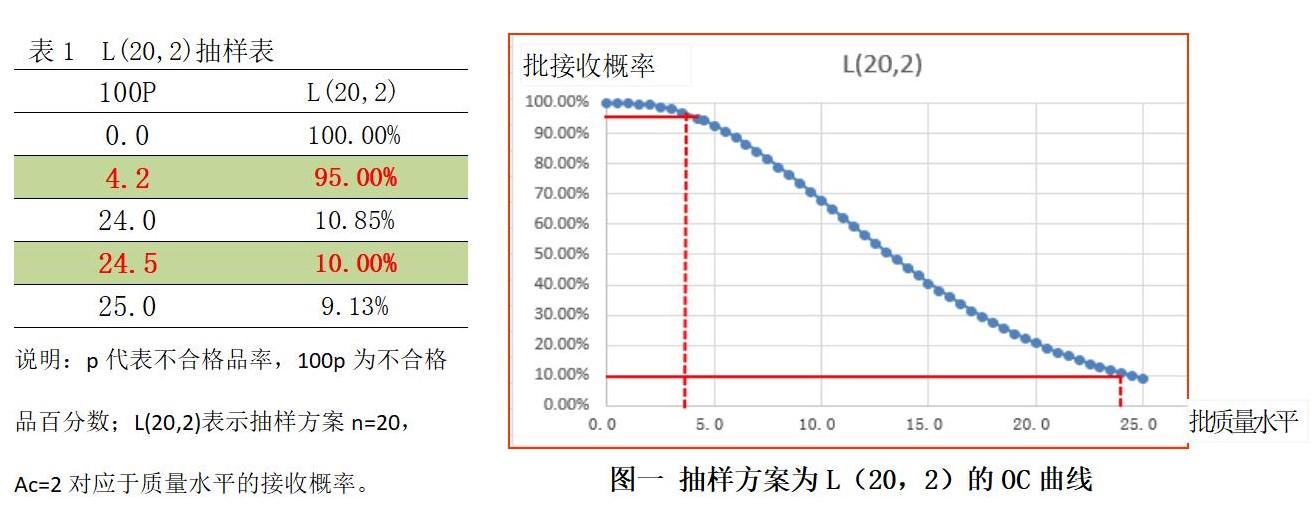
从上面表1和图一,可以看到,当批不合格品率为4.2%(AQL=4.2)时,也就是批合格品率为95.8%时,批的接收概率为95%,拒收概率为1-95%=5%;当批产品的不合格品率达到24.5%(RQL=24.5)时,因为抽样误差的原因,仍然会有10%的批次产品被当合格批次接收。
这样低的批产品质量24.5%,仍然会有10%的批次被错误的接收,这风险是很高的,这也是市场上屡有抽检不合格批次曝光的原因之一。
我们再看一个中药口服液(合剂)单剂量装量检查,药典给出的抽样方案,取供试品5支,每支装量与标示量相比较,少于标示量的应不得多于1支,并不得少于98%。同上,可做如下计算,见下表2和图二:
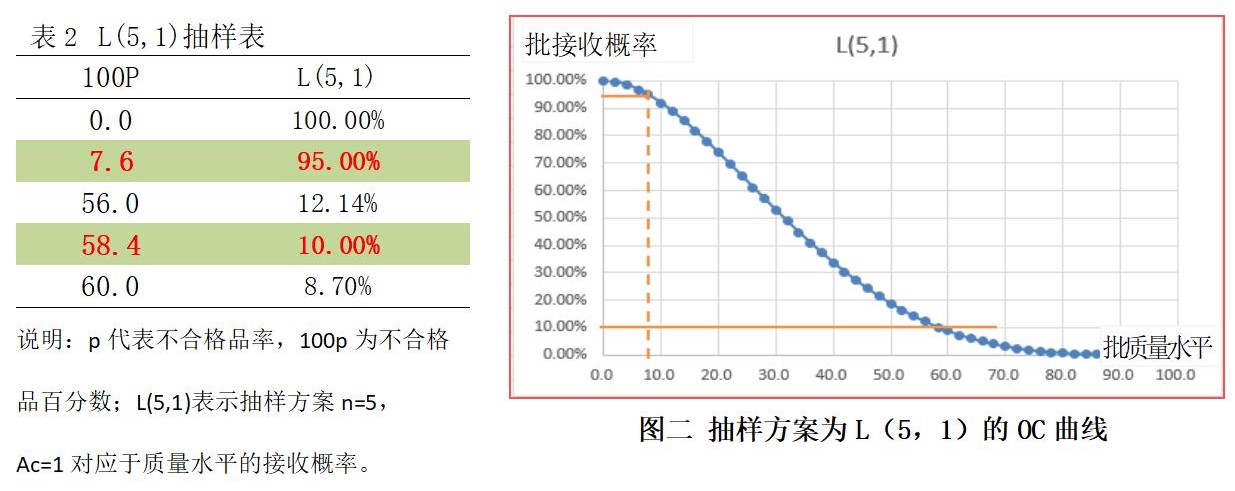
从上面的两个案例,我们看到药典给出的关于判定重量/装量差异的抽样方案,对于生产方和使用方来说都不是一个恰当的方案,这个方案并不好。
三、药典方案优劣分析
以上药典给出的抽样方案,存在以下的优缺点:
优点:
1.判定简单方便,将重量/装量检测结果与标准比较,得出合格与不合格的个数,再与标准比对即可,简单易行。
缺点:
1.没有给定批产品重量/装量差异检测项的质量水平(即不合格品率)是多少,再根据这个质量水平,设定相应的抽样方案。
2.将检查得到的计量型数据,如片剂的重量为X.XXg,降级为计数型数据(合格也不合格)使用,丢失了大量有用的信息,是一种倒退的分析方法。
3.抽样方案在生产方风险(α=5%)和使用方风险(β=10%)规定或已知的情况下,对应的生产方和使用方风险质量过高(如上例中7.6%和58.4%),使得批产品质量很差的批次产品,仍然以较高的概率被判定为合格批次而被放行和接收,即抽样方案不具有甄别优劣的能力,客观上保护了落后。
4.给生产企业一个错觉,产品装量/重量项的生产过程质量尚好,而市场抽检时,判不合格的风险大增,而不自知。
四、解决方案
既然目前药典在“重量/装量差异”检查项上,存在以上问题,应当怎么办呢?本文提供依次递进的3个解决方案,如下:
方案1:按GB/T 2828.1和2828.2的要求,增加样本量,减少供需双方的风险。
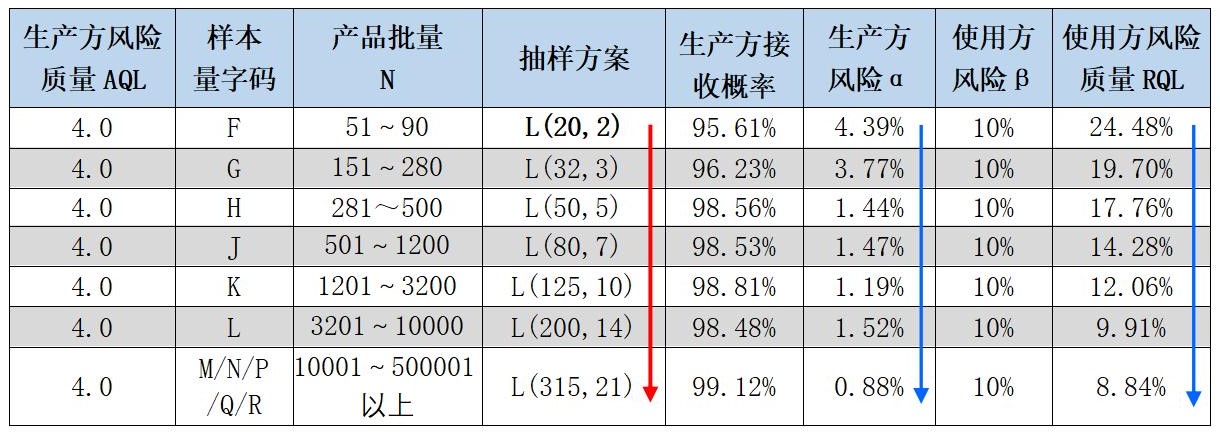
本方案属于简单粗暴型,是以国标GB/T 2828.1和2828.2为基础进行的。我们知道对于药品批放行检验来说,“重量/装量差异”项的检测,是破坏型(如装量差异),或检测后虽然样品外观没有被破坏,但也不能供销售/客户继续使用的;所以期望它检验的样本量要尽可能的少为好,但样本量减少的同时会带来供需双方风险的增大;反之,我们增加抽样的样本量(n)时,供需双方的风险会减少,但随之而来的是,抽样量和检验量的大幅增加、检验工作量和检验成本的大幅增加;下面以GB/T2828.1提供的L(20,2)抽样方案为例,具体如下表“表3 ”所示:
表3 生产方批质量水平AQL=4.0时,不同批量N下抽样方案供需双方风险对比表
从上表可以得出:
1.当批产品质量水平保持在4.0%时,随着抽样方案中样本量由20增加到315时,生产方风险α,由4.39%降低到0.88%;即批产品在质量合格(AQL达到标准要求或双方约定的4.0%)的情况下,因为抽样误差的原因,被错判为不合格批的概率由4.39%降低到0.88%,即100批中有4.39批错判,降低为100批中约有0.88批。
2.随着抽样方案中样本量由20增加到315时,使用方风险β保持10%不变,使用方风险质量RQL,由24.48%降低到8.84%;即做为顾客的使用方,当样本量增加时,因为抽样误差的原因,接收产品的批质量水平由24.48%降低到8.84%。
从以上分析的二点,可以看出来,增加样本量后,供需双方的风险的确都下降了,但是样本量却大幅度增加了,检验工作量和检验成本也随之大幅度提高。
这个方案在书本上、课堂里讨论一下是可以的。但,如果在企业里这么搞,基层员工不答应,老板首先要开人了,这显然不是一个实战的好方法。
那么,有没有更实战的方法呢,请看“关于中国药典里装(重)量差异检验法优劣问题的探讨(下)”
相关文件下载、服务及学习课程:
合规文库:药品GMP基础知识培训
合规培训:《药品检查管理办法(试行)》解读
合规服务:GMP合规审计(符合性检查)
联系专家,获取专家指导意见:e邀专家
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。







