如何解决数据可靠性中出现的问题
关于举办《如何解决数据可靠性中出现的问题》培训通知
2018 年3月 重庆市
1800 元/人(含教材费、证书费、会务费)
一、举办背景
自 FDA、欧盟、WHO、PICS 发布数据完整性指南(或草案)以来,数据可靠性成为全球关注的焦点,国家食品药品监督管理总局于2017 年8 月25 日也发布了《药品数据管理规范(征求意见稿)》。如何在实际工作中或操作层面上,严格执行规范,加强药品数据管理,达到数据可靠性的要求,成了业界最为关心的问题。为了帮助各药品研制、生产、流通企业的有关人员做好相关工作,解决企业在数据可靠性管理中遇到的疑难问题,飞天教育将举办“如何解决数据可靠性中出现的问题”培训班,现就有关培训事项通知如下:
二、 会议内容(日程安排详见附件)
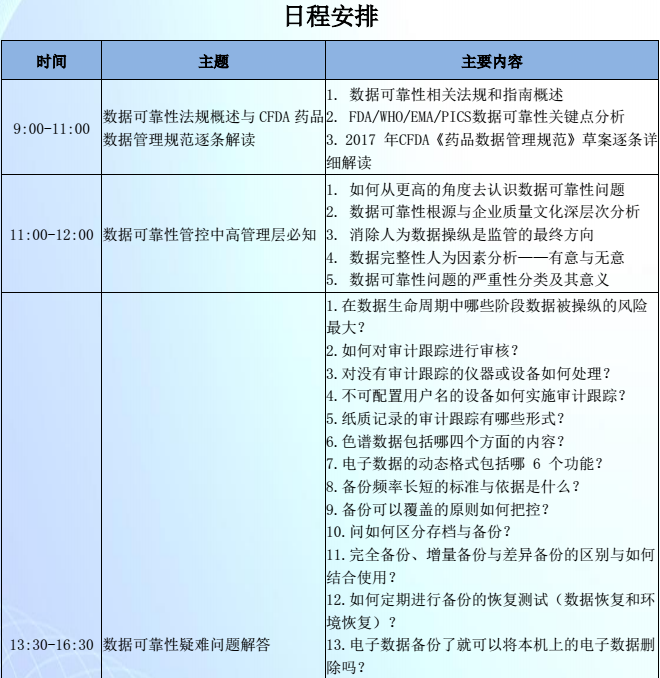
1、数据可靠性法规概述与CFDA 药品数据管理规范逐条解读
2、数据可靠性管控中高管理层必知
3、数据可靠性疑难问题解答
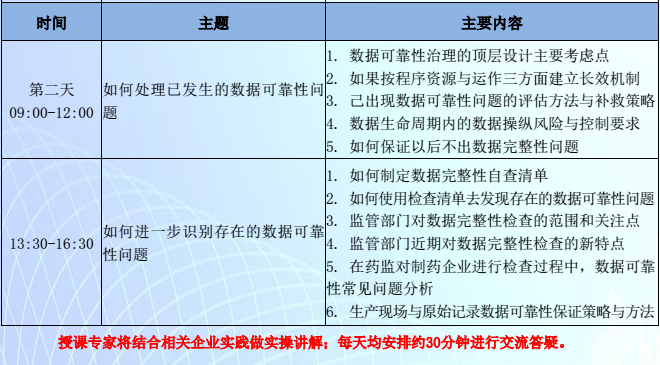
4、如何处理已发生的数据可靠性问题
5、如何进一步识别存在的数据可靠性问题
主讲人:徐禾丰 国家食品药品监督管理局特聘讲师,商务部医药进出口技术服务中心专家,曾多次为GMP检查员、各省局和制药企业进行培训。从事制药行业29年,在欧美药政法规、GMP实践、实验室管控、验证、风险分析等领域均有很深的造诣;参与编写出版了《GMP实训教程》、《ICH 原料药质量控制系列文件及APIC-Q7 如何实施》以及《制药工艺的验证》、《欧盟GMP/GDP法规汇编》等书籍。
主讲人:柯争先 ISPE国际制药工程协会会员,曾多次受邀各省局和制药企业进行计
算机化系统验证培训。曾参与和负责华北制药、哈药、海正药业、天坛生物、万邦医药等多个大型高端认证标准项目的项目管理、GEP咨询、验证及GMP咨询、Part11及GAMP5咨询、FDA迎检整改等活动。参与编写《制药工艺验证实施手册》、《欧盟GMP/GDP法规汇编》、《制药行业制造执行系统实施手册》等书籍。
三、热门课题如下:
1、《生命周期方法的工艺验证和清洁验证实务》提高班
2、《药品生产全过程质量风险管理与统计分析》提高班
3、《药品共线生产风险控制与设施、设备要求及案例分析》专题培训班
4、《制药行业GMP质量管理与工艺验证数据统计分析应用与实践》提高班
5、《药品QC微生物实验室管理及技术应用》专题培训班
6、《飞行检查常态下的制药企业GMP维护与实践应用实务班》专题培训班
7、《符合新版GMP的设备预防性维护与计量管理》培训班
8、《制药企业飞行检查应用》实务班
9、《药品GMP计算机化系统验证》实操训练班
10、《实验室控制验证及GMP符合性》专题培训班
四、参会对象
制药企业、医药研发等相关专业人员;药品生产企业负责厂房、设施、设备的工程技术人员及质量管理人员、控制室人员、验证人员、法规事务部人员,生产部门负责人、车间主任及有关技术人员、生产副总;项目工程师,验证经理及QA人员。
咨询电话:17301029586 彭倩
报到通知(详细时间、地点、乘车路线等信息)将于开班前 5 天通知学员