国家药监局器审中心关于发布基因测序仪临床评价注册审查指导原则等3项指导原则的通告(2022年第40号)
政策公告 全国

为进一步规范基因测序仪临床评价等申报资料的管理,国家药监局器审中心组织制定了《基因测序仪临床评价注册审查指导原则》《来源于人的生物样本库样本用于体外诊断试剂临床试验的指导原则》《微卫星不稳定性(MSI)检测试剂临床试验注册审查指导原则》等3项指导原则,现予发布。
特此通告。
附件:
2.来源于人的生物样本库样本用于体外诊断试剂临床试验的指导原则
3.微卫星不稳定性(MSI)检测试剂临床试验注册审查指导原则
国家药品监督管理局
医疗器械技术审评中心
2022年11月22日
基因测序仪临床评价注册审查指导原则
本指导原则旨在指导注册申请人对基因测序仪注册申报资料的准备及撰写,同时也为技术审评部门提供参考。
本指导原则是对基因测序仪的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由并提供相应的科学依据,同时依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围
本指导原则适用于高通量测序的基因测序仪采用通过同品种医疗器械临床数据或通过自身临床试验数据进行临床评价。
目前高通量基因测序技术即指第二代测序技术或下一代测序(Next Generation Sequencing 或NGS)技术,其技术特征是:(1)通过测定单元的高度并行化来实现高通量;(2)由于化学、物理等原理的限制,序列读长较短,一般在150~300bp(个别原理可以实现>600bp,比如焦磷酸测序法);(3)核心技术成熟。使用元件(比如Flow Cell、硅基阵列、微流控电导结构等)的加工技术(一般在微米尺度以上)技术成熟,器件结构和性能稳定。其化学原理主要包括DNA聚合酶循环测序法和DNA连接酶循环测序法(单色或多色荧光底物标记),如基于聚合酶的联合探针锚定聚合法、基于底物特征的可逆末端终止法,以及基于电学原理和光学原理的焦磷酸测序方案等。基于其他技术的基因测序仪产品,可参照本指导原则相关适用条款并结合产品特点准备注册申报资料。
本指导原则适用于申请产品注册和相关变更注册的产品。
申请人应当按照《医疗器械临床评价技术指导原则》的要求,选择通过同品种医疗器械临床数据或者临床试验这两种评价路径中适用的任一方式提交临床评价资料。
二、临床评价资料
(一)同品种临床评价路径的基本要求
1.同品种医疗器械判定
申请人可按照《医疗器械临床评价技术指导原则》中“同品种医疗器械”的定义和判定,选择已在境内获准注册的对比器械,根据申报产品特征选择合适的对比项目,分析对比器械是否符合同品种医疗器械的要求。
申请人所选取的同品种医疗器械应与申报产品适用范围相同,基本原理相同,关键功能模块构成相同、性能相似,关键指标没有显著差异。
2.申报产品与对比器械的等同性论证
选择合适的对比器械后,应进行相关项目的对比以论证其等同性。对比项目包括但不限于附件1所列举的项目。对比内容包括定性和定量数据、验证和确认结果,应详述二者的相同性和差异性,对于相同性,应提交充分的证据(如产品说明书、审评报告、检验报告、技术要求等)并明确证据来源。对差异性是否对产品的安全有效性产生不利影响,应通过申报产品自身的数据进行验证和/或确认。
对比申报产品和同品种产品在适用范围的相同性和差异性,建议重点考虑可检测的核酸类型、变异类型以及对使用环境的要求。
基本原理应重点关注生化原理(包括但不限于酶学反应、信号发生、信号源强度等)、物理原理(包括但不限于信号采集部件、光源、滤光器件等)、碱基对序列判断和质量评估原理(包括但不限于碱基对序列判断算法、核心数据集、错误率评估、系统弱点评估等)、系统集成原理和性能(包括但不限于:系统结构、核心模块、系统操控软件、操控人需求、可靠性等)等原理和基本性能等。
对于结构及功能模块,建议结合图示标注及性能参数进行对比。
关键指标应重点关注数据质量(包含所测序列中每个碱基的准确度:一般为仪器或分析软件系统的碱基判定时特有的质量值)、一次运行的数据产量(包括平均产量、最大产量、在不同质量阈值下的平均产量等)、测序在一定质量阈值下的平均读长(可包括高质量的最长读长和最短可用读长等)、仪器指定的不同测序模式、不同测序模式产生的数据量和运行时间差异等。
根据上述比较,如对比产品不符合同品种产品要求的,应重新选择对比产品进行同品种比较或补充申报产品的临床试验资料;如申报产品与对比器械可判定为同品种产品,还需对两者之间的差异进行阐述并对是否对产品安全性、有效性产生不利影响进行进一步评价。相关内容可参考《医疗器械临床评价等同性论证技术指导原则》。
3.差异性部分的安全有效性证据
针对申报产品与对比器械之间的差异,注册申请人需提交充分的科学证据证明二者的安全有效性等同。
科学证据包括但不限于:差异对下个模块性能或步骤的影响研究,差异对数据质量的影响研究。通常为研究资料或验证报告等。科学证据应详细说明针对差异进行的研究方式及研究结果,通常需包括准确、可靠、完整、可追溯的数据,必要时包括数据的产生过程,试验数据建议来自有良好质量控制的实验室;应进一步评价差异是否影响性能,以及影响的程度和范围,必要时提供临床试验数据进行确认。
不同情形所需提交的支持性资料不尽相同,申请人应当根据具体差异点提供相应的支持性资料,资料的类型和数量应根据申报产品和对比产品的差异点对产品安全性、有效性的影响进行确定。具体内容可参考表1,表1中具体情况举例可能不能涵盖所有情况,申请人应根据申报产品的具体情况进行列举和判定,并给出判定的具体理由。
表1 申报产品与对比产品关系及需提交资料类型表
申报产品与对比产品关系 | 申报产品与对比产品差异类型 | 具体情况举例 | 需提交资料类型 |
属于同品种 | 通常提交非临床研究可能充分证明的差异 | 1.申报产品适用范围不超出对比产品。 2.申报产品芯片密度与对比产品相当,仅数量不一致,后期信号数据处理基本一致。 3.申报产品流动液路系统的性能与对比产品不一致。 以上差异未造成明显性能差异和数据质量下降。 | 通常提交非临床研究可能充分证明的差异:非临床研究、和/或临床文献数据、和/或临床经验数据 |
需要提交临床试验资料的差异 | 1.申报产品适用范围多于同品种产品。 2.申报产品较同品种产品集成判读功能。 | 针对差异的临床试验资料 | |
不属于同品种 | 1.申报产品的基本原理与对比产品不相同。例如检测原理和碱基判读方法等。 2.申报产品的关键模块的构成与对比产品不相同。 3.申报产品的产品类型与对比产品不相同。如便携式、固定式(台式/落地式)。 4.申报产品关键模块的原理与对比产品不一致。如成像模块的原理不一致。 5.申报产品的性能与对比产品差异较大(最大读长、通量、数据质量等)。 | 重新选择同品种产品进行比较或补充申报产品的临床试验资料 |
对于较同品种产品增加的适用范围,应提交申报产品针对差异性的临床试验数据作为支持性资料。
对于存在多个差异点的情况,申请人应当完整地列出申报产品与同品种基因测序仪的所有差异点,并说明这些差异点的相互关系。若不同差异点之间存在相关性或相互影响,则应提供单个差异点影响的研究证据和关联性差异点共存时影响的研究证据。
基于申报产品和同品种基因测序仪的对比结果,如果非临床研究、临床文献数据、临床经验数据等无法充分地证明该差异对产品安全性和有效性的影响,则申请人应提供相应的临床试验资料。
通过对相应的性能及数据质量的评价,结果显示没有显著差异的,可认为申报产品与同品种产品基本等同。则可收集同品种产品的临床数据集,以证明申报产品自身的安全有效性。
4.同品种医疗器械的临床数据总结
如果判定申报产品与对比器械基本等同,则可收集同品种医疗器械的临床数据集,以证明申报产品的安全有效性。同品种医疗器械临床数据的收集、同品种医疗器械临床数据分析评价方法、临床评价报告撰写等方面的具体内容可参照《医疗器械临床评价技术指导原则》及《医疗器械注册申报临床评价报告技术指导原则》的相关规定。
对于同品种产品在临床应用时产生的安全有效性数据,应考虑选择不同变异类型、不同核酸类型的临床检测项目及数据质量。
(二)临床试验路径的基本要求
临床试验的开展、方案的制定以及报告的撰写均应符合相关法规、指导原则的要求,如相关法规、指导原则有更新,临床试验应符合更新后的要求。下面仅说明该类产品临床试验中应关注的重点问题。
1.临床试验机构
应选择不少于两家(含两家)符合要求的临床试验机构开展临床试验。临床试验机构应具备相应的检测资质和人员。
2.临床试验目的及设计
(1)临床试验目的
通过试验医疗器械与临床参考方法或已上市同类产品进行比较研究,确认试验医疗器械的安全性、临床性能和/或有效性。
(2)对比方法的选择
对于已有同类产品上市的临床研究,可以选择临床参考方法或已在中国境内上市的同类产品作为对照。如选同类产品作为对照,建议选择目前在临床检测方面使用状况良好的机型,应注意试验医疗器械的适用范围不应超过同类产品的适用范围,同时应提供对照产品的信息,如生产企业、型号、适用范围等。如试验医疗器械的适用范围超过已批准上市同类产品,可在以同类产品作为对照对相同的适用范围进行评价的同时,另外选择临床参考方法作为对比方法,对超出同类产品的适用范围进行临床评价。
对于无同类已上市产品的临床研究,可选择临床参考方法作为对比方法进行比较研究,以评价试验医疗器械的临床性能。
临床试验中还应对试验医疗器械和对比方法检测结果不一致样本进行分析,以明确结果不一致的原因。
(3)研究项目的选择
如试验医疗器械的适用范围为对来源于人体样本的人脱氧核糖核酸(DNA)进行测序,以检测基因序列变化,至少应选择人类基因靶向测序以及非靶向测序项目进行评价。其中人类基因靶向测序,建议选择肿瘤组织的基因突变为对象,应包括代表性的突变类型,至少包括点突变、小片段的插入/缺失、拷贝数变化;非靶向测序项目可选择胎儿染色体非整倍体检测。如适用范围还包括核糖核酸(RNA)的测序,即将RNA逆转录成DNA后进行测序,则还应对基因融合(如ALK融合)进行验证。
如试验医疗器械的适用范围不限于人DNA,应充分考虑产品适用的临床预期用途选择合适的代表性项目进行评价。
应根据试验医疗器械所声称的适用范围,选择代表性的检测项目进行临床评价,同时应考虑到不同样本类型。应根据临床试验中所选择的临床项目,制定受试者的选择标准,即入选和排除标准。同时受试者年龄、性别分布应均衡合理,充分考虑人种、地域差异对试验结果的影响。同时选择代表性的临床项目时,应考虑避免偏倚,试验过程中应注意盲法。
(4)临床评价指标
主要评价指标一般为检测准确性(灵敏度、特异度)或检测一致性(阳性/阴性符合率、总符合率、Kappa值等),主要评价指标应能够满足评价产品临床性能的要求。
同时申请人还应对临床试验检测项目进行数据质量的分析。
次要评价指标一般包括仪器功能、稳定性、使用便捷性、使用安全性等。
(5)样本量估算
为实现抽样样本代替总体的目的,临床试验需要一定的受试者数量(样本量)。样本量一般以临床试验的主要评价指标进行估算。需在临床试验方案中说明样本量估算的相关要素及其确定依据、样本量的具体计算方法。主要评价指标的相关参数根据已有临床数据和探索性性试验(如有)的结果来估算,需要在临床试验方案中明确这些估计值的确定依据。一般情况下,Ⅰ类错误概率α设定为双侧0.05或单侧0.025,Ⅱ类错误概率β设定为不大于0.2,预期受试者脱落和方案违背的比例不大于0.2,申请人可根据产品特征和试验设计的具体情形采用不同的取值,需充分论证其合理性。
如临床试验采用试验医疗器械与已上市同类产品进行比较研究的试验设计,建议采用单组目标值法样本量公式估算最低样本量。
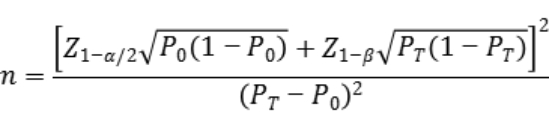
公式中,n为样本量;Z1-α/2、Z1-β为显著性水平和把握度的标准正态分布的分数位,P0为评价指标的临床可接受标准,PT为试验用体外诊断试剂评价指标预期值。
对于所选择进行临床验证的代表性项目大类,如人类基因靶向测序,总样本量应满足统计学要求,其中每种代表性的突变类型均应有一定例数。对于病原体检测,每一个代表项目的总样本量应满足统计学要求。
(6)统计分析
应选择合适的统计方法对临床试验结果进行统计分析,对于试验医疗器械与参考方法/已上市同类产品的一致性评价,一般选择2×2四格表的形式总结两种产品的检测结果,并据此计算灵敏度/特异度、阳性/阴性符合率、Kappa值等指标及其95%置信区间。
对于不一致样本,应进行原因分析。如临床试验方案规定采用其他方法进行确认,则确认结果不应纳入统计分析。
对于临床试验检测项目的数据质量的分析,应至少包括原始数据质量以及用于判读的数据质量,进行整体数据分析和分层统计。应关注数据质量的独立评价和相互的可比性,明确每运行最大和最小数据量、有效数据和仪器设定阈值、碱基质量评估方法和软件等。整体数据分析通常关注数据量、碱基识别质量值、高质量数据与总体粗数据产出的比例、靶区域总体覆盖度和均一性、根据背景序列GC含量不同的覆盖差异、比对质量值等指标。分层统计应结合项目具体要求,统计相应指标在不同数据指标水平下的样本分布。对数据质量较低的样本数据进行原因的分析和解释。
对于次要评价指标,仪器功能一般主要分析仪器运行过程中是否能实时监测运行状态并自动对用户进行提示、异常状态报警功能、运行过程追踪记录功能、数据备份功能、样本/反应载体/试剂正确识别功能等;稳定性主要分析仪器在临床试验过程中可持续正常工作;使用便捷性主要分析试验参数设置的便捷性及操作界面友好性等;使用安全性主要包括机械安全性、电气安全性、噪声安全性、生物安全性等。
3.质量控制
临床试验开始前,建议进行临床试验的培训,以熟悉并掌握相关试验方法的操作、仪器、技术性能等,最大限度控制试验误差。整个试验过程都应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
三、决策是否开展医疗器械临床试验
对于具有下列情形之一的产品,通过同品种医疗器械临床数据进行分析评价无法充分证明产品安全性、有效性的,应当进行临床试验,包括:
1.申报产品或其某关键模块(含软件)具有全新的技术特性,或者数据质量具有显著差异。
2.申报产品具有新的临床预期使用场景和功能,且该功能从未在境内获得批准。
3.针对与同品种医疗器械之间的差异,若不能通过非临床研究数据、临床应用数据等证据资料证明申报产品的安全性和有效性,申请人需要考虑通过临床试验来获得临床数据。
具体决策是否开展医疗器械临床试验可参照《决策是否开展医疗器械临床试验技术指导原则》,并提供充分的依据。
四、参考文献
[1]医疗器械临床评价技术指导原则[Z]
[2]医疗器械临床试验质量管理规范[Z]
[3]医疗器械临床试验设计指导原则[Z]
[4]医疗器械临床评价等同性论证技术指导原则[Z]
[5]决策是否开展医疗器械临床试验技术指导原则[Z]
[6]医疗器械注册申报临床评价报告技术指导原则[Z]
[7]YY/T 1723高通量基因测序仪[S]
来源于人的生物样本库样本用于体外诊断试剂临床试验的指导原则
本指导原则旨在明确来源于人的生物样本库(以下简称“生物样本库”)样本用于体外诊断试剂临床试验的相关要求,从而指导申办者的临床试验工作,也为技术审评部门对临床试验资料的技术审评提供参考。
本指导原则仅针对临床试验中生物样本库样本使用的相关问题进行讨论和规范,临床试验的设计、实施和报告等应符合相关法规、规章和规范性文件的要求。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善本指导原则相关内容也将适时进行调整。
一、适用范围
本指导原则适用于按照医疗器械管理的体外诊断试剂临床试验中,涉及到入组生物样本库样本的情形。
生物样本库是既往留存样本的来源之一,对于其他类似的情形,如适用,亦可参照本指导原则执行。
二、生物样本库样本用于体外诊断试剂临床试验的要求
体外诊断试剂临床试验中,原则上应在制定临床试验方案后,按照方案规定的入组/排除标准、受试者招募方式、样本采集方式等进行受试者入组并采集样本。这样的临床试验设计有助于确保受试人群能够代表目标人群的各种特征,从而对试验体外诊断试剂临床性能进行科学的评价,为证明试验体外诊断试剂安全有效、支持说明书宣称的预期用途提供充分证据。在某些特殊情况下,以上述方式入组足够数量的样本难以实现,可能使用既往留存样本集作为临床试验样本入组的补充方式(例如,某些稀有样本入组),或者既往留存样本入组不仅限于少数样本的补充、还会在临床试验样本中占有一定比例。规范化、标准化管理的生物样本库是其中可选择的样本来源之一。
纳入既往样本时需要充分考虑可能引入偏倚的因素,并进行严格的控制,保证临床试验结果尽量真实地反映试验体外诊断试剂在目标人群中的临床性能。对于经分析认为既往样本纳入时无法对可能发生的偏倚进行有效控制的,临床试验应严格按照预先设定的方案进行受试者入组和样本采集。
用于预测、预后、风险评估、疾病筛查等用途的体外诊断试剂,检测结果一般用于评价受试者未来的某种目标状态,亦可能需要进行受试者随访,一般情况下需要按照预先设定的临床试验方案进行受试者入组和样本采集;如纳入生物样本库样本需要有充分的证据证明试验设计的科学性和合理性,并特别注意避免引入偏倚。
(一)基本要求
生物样本库是可选择的既往留存样本集之一。生物样本库样本用于体外诊断试剂临床试验应满足以下基本要求:
1.临床试验如允许纳入生物样本库样本应有充分的理由,并进行相应的偏倚控制。
2.生物样本库中生物样本和相关数据的采集、保存和应用等应符合基本的伦理准则,保护受试者隐私,且不会给受试者带来额外的风险。
3.生物样本库样本的管理和使用应符合《中华人民共和国生物安全法》《中华人民共和国人类遗传资源管理条例》等法律法规及相关部门规章的要求,且应进行规范化、标准化的管理,符合有关生物样本库质量和管理的国家、行业标准及技术规范要求,建立适当的质量管理体系,获得必要的样本保藏资质,应有定期的质量控制和质量检验。
4.生物样本库中的样本应具有拟开展临床试验所需的必要的受试者临床背景信息,剩余样本量满足临床试验需求;从样本库建立到临床试验开展期间,样本采集和储存技术以及疾病诊断标准、诊断方法等没有发生影响试验体外诊断试剂临床性能评价的实质性变化,导致不能入组该临床试验。
5.入组的生物样本库样本应尽量为原始样本,且样本类型符合临床试验方案要求,不建议采用人体生物样本的衍生物,例如:从人体生物样本中提取纯化的核酸等。
6.生物样本库只能作为样本入组的来源,相关临床试验仍应在具备相应条件且按照规定备案的医疗器械临床试验机构开展。需要从生物样本库入组样本时,原则上,样本来源应为本临床试验机构的生物样本库。
7.临床试验方案中应特别说明将允许入组生物样本库样本,相关方案经伦理委员会批准后方可实施。
(二)临床试验中偏倚的控制
生物样本库提供的是一个既定的样本集,根据生物样本库建立时样本选择和留存的目的,其中的样本可能具有某种既定特征,而这种特征可能不能完全代表临床试验预期目标人群的全部特征;生物样本库建立时,样本的可及性、获取的难易程度、与患者目标状态相关的其他因素等可能影响生物样本库样本对于临床试验预期目标人群的代表性;生物样本库样本的采集方式、处理方式、储存条件和时间等可能与临床试验要求不同;生物样本库建立与临床试验开展之间的时间间隔可能影响生物样本库样本以及相关数据对于临床试验的适用性。上述问题均应在临床试验偏倚的控制中予以考虑。
1.特殊情况下,临床试验需要纳入生物样本库样本,如果生物样本库样本仅用来补充某些稀有样本,不是临床试验主要的样本入组来源,这种情况下可能涉及如下问题需要考虑:
1.1临床试验中,经过编盲后,试验操作者和结果判读者应不能区分样本是来自生物样本库的样本还是按照临床试验方案采集的样本。
1.2生物样本库样本采集方式、处理方式、储存条件和时间等应符合临床试验要求。应特别考虑目标被测物可能的降解是否会影响临床性能评价。
1.3临床试验中有关受试者目标状态的临床诊断结论等,可以引用生物样本库中的相关数据,但需要确认临床诊断与样本采集同步进行,以避免因疾病进程不同引入偏倚;对于临床试验中目标被测物的检测(包括试验体外诊断试剂和对比方法等)则建议在临床试验中同步进行,不建议引用生物样本库中既往的检测数据,以避免由于检测不同步、样本储存时间差异较大引入偏倚。
1.4生物样本库样本的纳入可能导致具有罕见状况的受试者在临床试验受试人群中的比例显著高于在自然状态下目标人群总体中的比例,这个潜在偏倚应在统计分析中加以考虑。
2.如果生物样本库样本不止用于少数样本的补充,而是在临床试验中占有一定比例,则除上述问题以外,还需格外注意充分论证可能的受试者选择偏倚等问题:
2.1应充分了解生物样本库建立的目的、样本接收范围等,确定受试人群是否能够代表临床试验目标人群的各种特征(而不仅仅是最典型的特征)。
2.2一般的,临床试验受试者入组时应实现随机抽样的原则,从而使受试人群(抽样)对目标人群(总体)具有良好的代表性。如果临床试验需要纳入生物样本库样本,且样本量占有一定比例,则为了保证受试人群的代表性,生物样本库样本量应足够大,从而在一定程度上满足随机抽样的要求。涉及稀有样本入组时可根据临床试验目的综合考虑。
2.3生物样本库建立后是否存在非随机的样本剔除或耗尽等,使得生物样本库的样本组成发生非随机的变化(例如与样本稳定性或受试者目标状态相关的样本库组成结构变化),导致临床试验目标人群的某些特征缺少代表性。
三、生物样本库样本用于体外诊断试剂临床试验的资料要求
体外诊断试剂临床试验中如纳入生物样本库样本,临床试验方案中应特别说明该情况,并列出样本入组的具体规定,包括:
1.入组标准、入组方式,样本质量要求,以及避免引入偏倚的措施;
2.样本运输和储存要求、数据传输方式和内容、记录保存要求等;
3.伦理考虑,包括知情同意、受试者隐私保护、受试者风险和权益保护等方面的考虑,应符合有关医疗卫生机构人类生物样本管理办法的要求。应提交伦理委员会同意按照相关方案开展临床试验的书面意见。
如生物样本库样本和相关数据的采集、保存和应用按照规定获得了相关受试者的知情同意,应按照法规要求提交知情同意书样本。
临床试验报告应针对方案中有关生物样本库样本入组和使用的相关要求陈述具体的实施情况,并对可能的偏倚进行分析。
必要时应提供生物样本库质量控制和质量检验的相关记录或文件。
四、其他
以上针对生物样本库样本用于体外诊断试剂临床试验可能涉及到的伦理、样本质量以及偏倚控制问题提出了原则性的建议和要求。如临床试验中涉及到其他特殊的情况,可能不能完全满足上述要求时,应在充分论证合理性的前提下,在临床试验方案中详述理由,并明确样本入组和试验操作方法,经伦理委员会批准后在临床试验中执行。临床试验全过程应符合《医疗器械临床试验质量管理规范》的相关要求。
五、参考文献
[1]医疗器械临床试验质量管理规范[Z].
[2]Design Considerations for Pivotal Clinical Investigations for Medical Devices. FDA, 2013.11.7
[3]Guidance on Informed Consent for In Vitro Diagnostic Device Studies Using Leftover Human Specimens that are Not Individually Identifiable. FDA, 2006.4.25
[4]Clinical Evidence for IVD Medical Devices - Clinical Performance Studies for In Vitro Diagnostic Medical Devices. GHTF/SG5/N8:2012.
[5]中华人民共和国生物安全法[Z].
[6]中华人民共和国人类遗传资源管理条例[Z].
[7]GB/T 37864, 生物样本库质量和能力通用要求[S].
[8]郜恒骏.中国生物样本库-理论与实践[M].北京:科学出版社,2017.
微卫星不稳定性(MSI)检测试剂临床评价注册审查指导原则
本指导原则旨在指导注册申请人对微卫星不稳定性(MSI)检测试剂临床评价资料的准备及撰写,同时也为技术审评部门提供参考。
本指导原则是对微卫星不稳定性(MSI)检测试剂临床评价的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审查人员的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围
本指导原则适用于采用荧光PCR-毛细管电泳法检测结直肠癌患者肿瘤组织细胞基因组DNA中的MSI状态,从而辅助鉴别结直肠癌中可能的林奇综合征患者的体外诊断试剂。
对于采用其他检测技术进行MSI检测的产品,申请人可以根据产品特性考虑本指导原则的适用性,对不适用部分采用其他适当的评价方法,但需阐述不适用的理由,并验证替代方法的科学合理性。特别是采用NGS方法检测MSI时,在检测位点、判读方法等方面均与毛细管电泳法有显著差异,应从检验原理的特点出发,设计科学的评价方法对产品临床性能进行综合评价。如申请其他预期用途,例如免疫治疗药物的伴随诊断,申请人应针对该预期用途提供充分的临床性能评价资料。
本指导原则适用于进行体外诊断试剂产品注册申请和变更注册申请的产品,重点针对临床评价资料的准备及撰写明确要求。
有关此类产品的背景信息以及本指导原则适用范围确定的依据参见附件。
二、注册审查要点
(一)临床评价资料
1.临床评价路径和基本要求
该类试剂应通过临床试验路径进行临床评价,临床试验的开展应符合《体外诊断试剂注册与备案管理办法》《医疗器械临床试验质量管理规范》以及《体外诊断试剂临床试验技术指导原则》的相关要求,如相关法规、规章、规范性文件有更新,临床试验应符合更新后的要求。
2.临床试验开展应具备的基础
临床试验开展应建立在充分的临床前研究基础之上,包括科学的产品设计、充分的分析性能研究、阳性判断值研究等。
采用荧光PCR-毛细管电泳法进行MSI DNA检测,一般对肿瘤组织与正常对照样本分别进行相应微卫星位点检测,将两者检测峰图进行比较,确定肿瘤组织中是否发生了微卫星序列长度的变化(按照一定的阳性判断值判定),同时通过设定适当的判定标准(发生序列长度变化的微卫星位点数量)确定肿瘤组织的MSI 状态(MSI-H、MSI-L/MSS)。MSI检测的灵敏度和特异度与位点选择、反应体系的确定、微卫星序列长度变化判定标准以及MSI-H判定标准等产品设计因素直接相关,产品设计开发中应进行充分的验证。同时,为了保证检测准确性和可重复性,应针对样本质量提出明确要求,例如组织样本中肿瘤细胞比例,核酸提取纯度和浓度等。
2.1微卫星位点选择
MSI检测试剂在产品设计中最关键的问题之一在于微卫星位点的选择。
1997年Bethesda指南中推荐的是一个简称为“2B3D”的微卫星位点组合(NCI panel),由 2个单核苷酸位点(BAT-25和BAT-26)和3个双核苷酸位点(D2S123、D5S346和D17S250)组成。同时,该指南中也推荐了针对这一组合的判定标准:即5个微卫星位点中2个或2个以上发生序列长度变化时,判定为MSI-H,1个发生序列长度变化时,判定为MSI-L,若5个微卫星位点均没有发生序列长度变化,则为微卫星稳定MSS。
2002年,NCI举办的第二次HNPCC研讨会上对MSI的检测进行了修订和补充,推荐了由5个单核苷酸微卫星位点构成的组合(Pentaplex Panel),经过后续修订,形成了包括BAT-25、BAT-26、NR-21、NR-24、NR-27在内的5个单核苷酸微卫星位点组合。
目前临床上还有BAT-25、BAT-26、NR-21、NR-24和MONO-27五个单核苷酸位点组合。
综上,多项研究对MSI检测提出了不同的微卫星位点组合,以单核苷酸微卫星位点为主,一般包括5个位点,各个组合之间略有交叉和互补。
在MSI检测试剂的设计过程中,申请人可依据相关文献资料,结合自身的前期研究数据,综合考虑备选位点在MSI-H患者中的阳性率、微卫星序列长度变化易读性等因素,选择适当的位点组合,并设定合理的判定标准,从而对MSI-H实现灵敏和特异的检测。申请人应特别关注针对中国人群的研究数据,位点组合应适合中国人群特点,满足中国人群的临床诊断需要。
最终临床试验数据应能够证明该组合对于结直肠癌中LS患者辅助筛选具有较高的临床灵敏度和良好的临床特异度。申报资料中,申请人应详述位点组合的选择依据,提供相关文献和数据。
2.2结果判读
每个微卫星位点毛细管电泳峰图的解读、微卫星序列长度变化的判定标准以及MSI-H和MSI-L/MSS的判定标准是直接影响到产品临床性能的关键要素,申请人应根据充分的临床前研究数据,同时参考科研论文和文献进行科学的设定,并在说明书中详细说明。特别是对于一些可能出现的不易判读的峰形,可在说明书中结合具体的图示和举例进行相应的说明。临床试验过程中严格按照说明书的要求进行操作和判读。
3.临床试验设计和实施的要求
临床试验应选择不少于3家(含3家)符合要求的临床试验机构开展。临床试验入组人群应为结直肠癌患者,样本量应满足统计学要求。
临床试验应按照说明书要求采集样本、评价样本质量、完成样本处理、检测和结果解读。试验中按要求进行相应的设盲操作,试验全过程注意避免引入偏倚。临床试验产生的所有信息应进行详实的记录。
临床性能评价应至少包括以下三方面研究:
3.1肿瘤组织细胞基因组MSI状态(MSI-H、MSI-L/MSS)判定的性能研究
3.1.1如果申报产品采用的微卫星位点组合已经得到临床广泛认可,则可以选择如下任一种方法进行此部分临床性能研究。
方法一:采用试验体外诊断试剂与MMR蛋白IHC检测进行比较研究,评价两种检测结果的一致性。
作为对比方法的MMR蛋白IHC检测应采用已获准上市、经临床实践认为性能良好的检测试剂盒,并在临床试验质量管理下完成检测。IHC检测的MMR蛋白主要包括MLH1、MSH2、MSH6和PMS2,四种蛋白均为阳性表达,则为pMMR,任一MMR蛋白缺失即为dMMR。检测过程中,样本处理和结果解读应符合相关操作规范和判读标准的要求,试验全过程做好质量控制。检测结果应由有经验的病理医生进行判读,并经双人复核。为避免机构之间差异,试验开始前应统一操作和判读标准,并进行适当的机构间一致性评价。临床试验报告中应总结IHC检测过程中的质控数据和结果。临床试验数据表中列出所有病理医生的判读结果和最终的结果解释。
入组病例中dMMR和pMMR病例例数应分别满足统计学要求,试验设计时可采用目标值法公式对最低样本量进行估算。
比较研究的试验结果采用四格表方式进行总结,计算阳性/阴性符合率和总符合率及其95%置信区间。对于两种方法检测结果不一致的样本,可结合患者LS相关基因胚系突变检测及其他临床诊断信息进行复核,也可以采用其他适当的方法对差异原因进行分析。
评价指标:与MMR蛋白IHC检测的阳性符合率、阴性符合率95%置信区间下限一般分别不低于90%和95%。
方法二:采用试验体外诊断试剂与已上市同类产品进行对比试验,评价两种试剂判定MSI-H和MSI-L/MSS的一致性。其中MSI-H和MSI-L/MSS样本例数应分别满足统计学要求,试验设计时可采用目标值法公式对最低样本量进行估算。两种试剂判定MSI-H和MSI-L/MSS的阳性符合率、阴性符合率95%置信区间下限一般不低于95%。
3.1.2如果申报产品采用全新的微卫星位点组合(包括全新的MSI-H判定标准),该组合在以往国内、外权威指南、规范等文件中均未有推荐,且尚未受到行业广泛认可,则应首选上述方法一进行临床性能评价,如有必要,申请人可同时结合方法二对产品临床性能进行更加全面的评价,证明申报产品对于MSI-H和MSI-L/MSS判定的性能能够满足临床需求。
3.2每个微卫星位点检测性能研究
采用试验体外诊断试剂与Sanger测序法或检测相同微卫星位点的已上市同类产品进行对比试验,评价试验体外诊断试剂与对比方法检测每个微卫星位点的一致性。
临床试验前可采用适当的方法对每种微卫星位点预期阳性(即有序列长度变化)例数和阴性(即无序列长度变化)例数进行最低样本量估算,保证样本量满足统计学要求。
针对每个微卫星位点的检测结果分别采用四格表方式进行总结,计算阳性/阴性符合率和总符合率及其95%置信区间。对于两种方法检测结果不一致的样本,可采用合理的方法进行复核,并逐一列出试验体外诊断试剂、对比方法以及复核方法的检测结果,如毛细管电泳图、Sanger测序序列图等,对差异原因进行详细分析。对于Sanger测序法,受到方法学限制,可能不能准确读出核苷酸重复个数,但通过正常对照样本和肿瘤组织样本的测序图谱对比应能够准确判定是否存在序列长度变化。
申请人应详述Sanger测序方法的建立、验证过程,特别是测序引物设计、测序靶序列选择(包括与试验体外诊断试剂扩增序列对比)、反应体系验证、测序结果判读以及该测序方法的最低检测限等性能验证数据,举例说明测序图谱的判读方法,必要时标示出串联重复序列的位置。应详述判读方法设定的依据。
评价指标:每个微卫星位点检测阳性、阴性符合率95%置信区间下限一般不低于90%。
3.3 MSI检测辅助鉴别结直肠癌中可能的LS患者的临床性能研究
采用试验体外诊断试剂与结直肠癌中LS诊断的临床参考标准,即LS相关基因(主要为MLH1、MSH2、MSH6、PMS2,少部分为EPCAM)胚系突变检测结果进行比较研究,评价产品临床性能。胚系突变检测可能涉及到NGS和MLPA(Multiplex Ligation- dependent Probe Amplification,多重连接探针扩增技术)(针对大片段缺失和插入)等方法;胚系突变的结果应依据国际上公认的指南和数据库等进行判定。临床试验资料中应针对胚系突变检测方法的建立和性能评价数据等进行详细描述,并明确结果判定的依据。
入组病例应包括LS相关基因胚系突变阳性(包括致病性突变和可能致病性突变)和阴性病例。为了避免受试人群的选择偏倚,建议针对符合入组标准的结直肠癌患者进行顺序入组,如其中LS相关基因胚系突变阳性病例较少,可以采用适当的方式进行富集。应注意:富集入组的LS相关基因胚系突变阳性病例应不是依据MSI检测进行筛选、并最终确诊的患者,或者所依据的MSI检测微卫星位点组合应与试验体外诊断试剂不同。
样本量可采用如下公式进行估算:
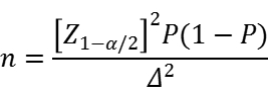
公式中n为样本量,Z1-α/2为置信度标准正态分布的分位数,P为评价指标预期值,Δ为P的允许误差大小。
例如,根据已有文献和数据,灵敏度预期值设为95%,特异度预期值设为85%,允许误差Δ取值0.05。则阳性组最低样本量为73例,阴性组最低样本量195例。
为保证临床性能评价的充分性,临床试验样本量建议不低于上述估算样本量,同时充分考虑可能的脱落率和临床性能评价的需要,设定入组样本量要求。
试验结果采用四格表方式进行总结,计算试验体外诊断试剂的临床灵敏度和特异度及其95%置信区间。应针对总样本、顺序入组样本和富集入组样本试验结果分别进行统计分析,其中顺序入组样本中,按照相关流行病学规律,应有一定数量LS相关基因胚系突变阳性样本。
对于假阴性和假阳性结果,应充分结合临床诊断的其他信息(例如基因胚系突变的具体情况、体细胞基因突变情况等)进行解释和分析。
4.临床试验方案、小结和报告
各临床试验机构应采用同一方案,并在整个临床试验过程中严格执行,不可随意改动。方案中对试验设计类型、对比方法选择、受试者选择、评价指标、统计分析方法、样本量估算和质量控制要求等做出明确的规定,并根据各临床试验机构情况合理确定样本量分配计划。各临床试验机构选用的对比方法应保持一致,以便进行合理的统计学分析。
各临床试验机构应对临床试验数据和实施情况进行总结,出具临床试验小结。
临床试验报告应对整体临床试验实施过程、结果分析、试验结论等进行条理分明的描述,并应包括必要的数据和统计分析方法。
(二)产品说明书
根据前文所述本指导原则适用产品的预期用途限定,产品说明书中【预期用途】项下建议描述为:本产品用于体外定性检测结直肠癌患者肿瘤组织FFPE样本基因组DNA中的微卫星位点……(列出待测微卫星位点名称),通过与正常对照样本检测结果对比,确定是否发生了微卫星序列长度变化。根据发生序列长度变化的微卫星位点数量,将结直肠癌分为微卫星高度不稳定(MSI-H)、微卫星低度不稳定(MSI-L)以及微卫星稳定(MSS)三种微卫星状态。检测结果用于辅助鉴别结直肠癌中可能的林奇综合征患者。
同时应注明:此类产品的应用应参考临床相关诊疗指南的要求,检测结果的解读应结合其他临床诊断信息、疾病家族史及实验室检测信息进行综合分析。
如未进行用药指导相关的临床试验,还应在说明书中注明:该产品尚未进行有关用药指导的临床性能评价。
三、参考文献
[1]体外诊断试剂注册与备案管理办法[Z].
[2]医疗器械临床试验质量管理规范[Z].
[3]体外诊断试剂临床试验技术指导原则[Z].
[4]NCCN Clinical Practice Guidelines in Oncology: Colon Cancer. Version 2.2021.
[5]Genetic/Familial High-Risk Assessment: Colorectal Version 1.2021, NCCN Clinical Practice Guidelines in Oncology.
[6]Sepulveda A R , Hamilton S R , Allegra C J , et al. Molecular Biomarkers for the Evaluation of Colorectal Cancer[J]. Journal of Molecular Diagnostics, 2017, 19(2):187-225.
[7]Asad U , Richard B C , Terdiman J P , et al. Revised Bethesda Guidelines for Hereditary Nonpolyposis Colorectal Cancer (Lynch Syndrome) and Microsatellite Instability[J]. Journal of the National Cancer Institute, 2004(4):936.
[8]中国临床肿瘤学会(CSCO)结直肠癌诊疗指南2021[M].人民卫生出版社,2019.
[9]中国临床肿瘤学会结直肠癌专家委员会,中国抗癌协会大肠癌专业委员会遗传学组,中国医师协会结直肠肿瘤专业委员会遗传专委会.结直肠癌及其他相关实体瘤微卫星不稳定性检测中国专家共识[J].中华肿瘤杂志,2019,41(10):734-741.
[10]中国抗癌协会大肠癌专业委员会遗传学组.遗传性结直肠癌临床诊治和家系管理中国专家共识[J].实用肿瘤杂志,2018,33(1):3-16.
[11]中国临床肿瘤学会(CSCO)结直肠癌专家委员会.结直肠癌分子标志物临床检测中国专家共识[J].中华胃肠外科杂志,2021,24(3):191-197.
[12]Lin Dong, Xianglan Jin, Wenmiao Wang, Qiurong Ye, Weihua Li, Susheng Shi, Lei Guo, Jianming Ying, Shuangmei Zou. Distinct clinical phenotype and genetic testing strategy for Lynch syndrome in China based on a large colorectal cancer cohort[J]. International journal of cancer, 2020, 146(11):3077-3086.
附件
关于微卫星不稳定性(MSI)检测试剂的背景介绍
一、微卫星与微卫星不稳定性
微卫星(microsatellite,MS)是指细胞基因组中以少数几个核苷酸(一般为1~6个,多为单碱基或双碱基)为单位串联重复的DNA序列,又称短串联重复(short tandem repeat,STR)。微卫星位点广泛存在于人类基因组中,约占基因组3%。
在正常状态下,微卫星的长度保持不变,并且稳定遗传;DNA错配修复(mismatch repair,MMR)功能出现异常时,微卫星出现的复制错误得不到纠正并不断累积,使得微卫星序列长度发生改变,称为微卫星不稳定性(microsatellite instability,MSI)。MSI根据程度可以被分成3类:微卫星高度不稳定(MSI-high,MSI-H)、微卫星低度不稳定(MSI-low,MSI-L)、微卫星稳定(microsatellite stability,MSS)。
MSI现象于1993年在结直肠癌中首次发现。随着研究深入,发现MSI现象不止存在于结直肠癌,在子宫内膜癌、胃癌、卵巢癌等实体瘤中均有发生。
二、MSI检测在结直肠癌中的临床意义
MSI是错配修复功能缺陷导致的结果。在临床实践中,错配修复功能状态可以通过MMR蛋白免疫组织化学法(immunohistochemistry, IHC)检测和MSI DNA检测来反映。IHC检测中错配修复蛋白均有表达即为错配修复功能完整(proficient mismatch repair,pMMR),任一错配修复蛋白缺失即为错配修复功能缺陷(deficient mismatch repair,dMMR);MSI DNA检测中,MSI-H通常提示为dMMR,MSI-L或MSS通常提示为pMMR。大量数据显示,MMR蛋白IHC检测和MSI DNA检测结果一致性可以达到90%以上。
根据国内、外结直肠癌诊疗指南推荐,在结直肠癌病理学诊断过程中,应进行MMR蛋白IHC或MSI DNA检测,从而确认患者的错配修复状态。其临床意义有以下几方面。
(一)MSI检测用于结直肠癌预后评价和用药指导
根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)结肠癌、直肠癌临床实践指南及中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)结直肠癌诊疗指南,MSI可能是结直肠癌的预后因子,并与结直肠癌患者化疗或免疫治疗效果有关。有研究表明,dMMR/MSI-H的II期结直肠癌患者预后良好,且不会从单药氟尿嘧啶类药物的辅助化疗中获益。dMMR/MSI-H的晚期/转移性结直肠癌患者可能从免疫治疗(PD-1单抗)中获益。
(二)MSI检测用于辅助鉴别结直肠癌中可能的林奇综合征患者
林奇综合征(Lynch syndrome,LS)是一种常染色体显性遗传性肿瘤综合征,2010年之前又被称为遗传性非息肉病性结直肠癌( hereditary non-polyposis colorectal cancer,HNPCC)。LS是最常见的遗传性结直肠癌综合征,约占结直肠癌发生率的3%。LS患者结直肠及其他多部位罹患恶性肿瘤的风险显著升高,且平均发病年龄较轻。LS相关的致病基因主要包括MMR家族中的MLH1、MSH2、MSH6或PMS2基因,此外EPCAM基因胚系突变引起MSH2不表达也是导致LS的机理之一。由于MMR基因的功能失活性改变,LS患者往往表现为dMMR和(或)MSI-H表型。
以往依据阿姆斯特丹标准( Amsterdam criteria)和Bethesda 指南(Bethesda criteria guidelines),结直肠癌中LS患者的识别和诊断主要依靠先证者的发病年龄、相关肿瘤家族史、组织病理学特征等,这种筛查策略的灵敏度较低。目前MMR蛋白IHC检测和(或)MSI DNA检测成为主流的LS筛查策略,CSCO结直肠癌诊疗指南推荐对于70岁以下(含70岁)结直肠癌患者均可进行MMR蛋白IHC检测和(或)MSI DNA检测以筛查可能的LS患者(二级推荐),dMMR/MSI-H 患者进行LS相关基因的胚系突变检测,以明确诊断。NCCN结肠癌、直肠癌临床实践指南等基于成本效益分析,认为可以对所有结直肠癌患者进行MMR蛋白IHC检测或MSI DNA检测,以筛查LS患者。
(三)指导原则适用范围的考虑
综合以上背景信息,MSI检测对于结直肠癌患者预后评价、用药指导和LS的辅助筛选有重要的临床意义。基于目前临床实践和体外诊断试剂审评经验,本指导原则适用的产品主要指预期用途限定为结直肠癌患者LS辅助筛选的诊断试剂,检测方法学主要针对荧光PCR-毛细管电泳法。
三、MMR蛋白IHC检测和MSI DNA检测的优势和局限
MMR蛋白IHC检测和MSI DNA检测在评价错配修复功能状态中各有优势和局限。
IHC检测的优势是操作简便,检测平台普及性高,并可以直接反映可能导致MSI-H发生的MMR缺陷基因,存在的问题是IHC影响因素较为复杂,常因样本前处理不规范和结果判读标准掌握不当导致结果不准确。此外,罕见的情况下,MMR基因的错义突变可能导致MMR蛋白的氨基酸序列发生改变,蛋白功能障碍,但抗原性完整,表现为MMR功能缺陷但IHC染色仍呈现正常表达的“假阴性”结果。
MSI的DNA检测更易标准化,可以实现较好的重复性。但只能选择若干确定的微卫星位点进行检测,有可能由于位点代表性问题造成“假阴性”,且检测条件要求较高、常需要配对受试者的正常对照样本。组织样本中肿瘤细胞比例低、肿瘤组织异质性等问题可能会影响检测质量,造成“假阴性”结果。此外,有研究表明,某些MSH6胚系突变发生时PCR检测可能表现为MSS,从而造成MSI检测针对LS的假阴性结果。
NCCN结直肠癌遗传高风险评估指南中指出,对于LS患者,IHC和MSI检测分别有5~10%的假阴性。
相关推荐
CIO提供以下相关文库下载、合规服务以及线上培训课程学习。
最新推荐

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






