细胞和基因治疗产品现状与我国监管政策研究
CIO专家-山丹
近年来,我国制药行业从仿制迈向创新,取得了诸多成果,为患者提供了更多的治疗手段。党的二十大报告[1]指出,我国生物医药等战略性新兴产业取得重大成果,进入创新型国家行列。2016年,《“健康中国2030”规划纲要》[2]将“干细胞与再生医学”列为医学前沿技术之一;2021年,免疫细胞治疗、干细胞治疗、基因治疗产品被纳入《“十四五”医药工业发展规划》[3];2022年,《“十四五”生物经济发展规划》发布,提出发展细胞和基因治疗产品等生物药[4]。国家政策层面的支持和引导为细胞和基因治疗产品的快速发展注入了强劲动力。
由于恶性肿瘤、遗传病、传染病和慢性病等疾病的临床需求未得到满足,而利用细胞和基因治疗技术有望实现治愈这类疾病,因此,细胞和基因治疗产品的研发已经成为热门领域。细胞和基因治疗产品主要包括:①人源性干细胞及其衍生细胞治疗产品,是指由人源性干细胞(包括人胚胎干细胞、成体干细胞和诱导多能干细胞)诱导分化,或成熟体细胞转分化获得的细胞治疗产品。②免疫细胞治疗产品,是指利用患者自身或供者来源的免疫细胞,经过体外培养扩增、活化或基因修饰、基因编辑等,再回输到患者体内,通过激发或增强机体免疫功能,从而控制疾病的细胞治疗产品。③基因治疗产品,主要包括核酸(质粒、RNA等)、表达特定基因的基因修饰微生物(病毒、细菌等)、体内编辑宿主基因组(通过或未通过特定的转录/翻译)的产品和未通过基因修饰表达特定基因的微生物(溶瘤病毒产品等)。
本文总结了国内外细胞和基因治疗产品在不同适应症领域的临床应用和产业发展现状,梳理了我国细胞和基因治疗产品监管政策发展历程,并从技术、监管和财务3个维度客观剖析了目前我国发展细胞和基因治疗产品面临的问题和挑战,探索性地提出建议,以期为突破制约产业发展的技术瓶颈、建立和完善符合我国国情的监管体系提供参考。
01 国内外细胞和基因治疗产品的临床应用及产业现状
1.1 临床应用
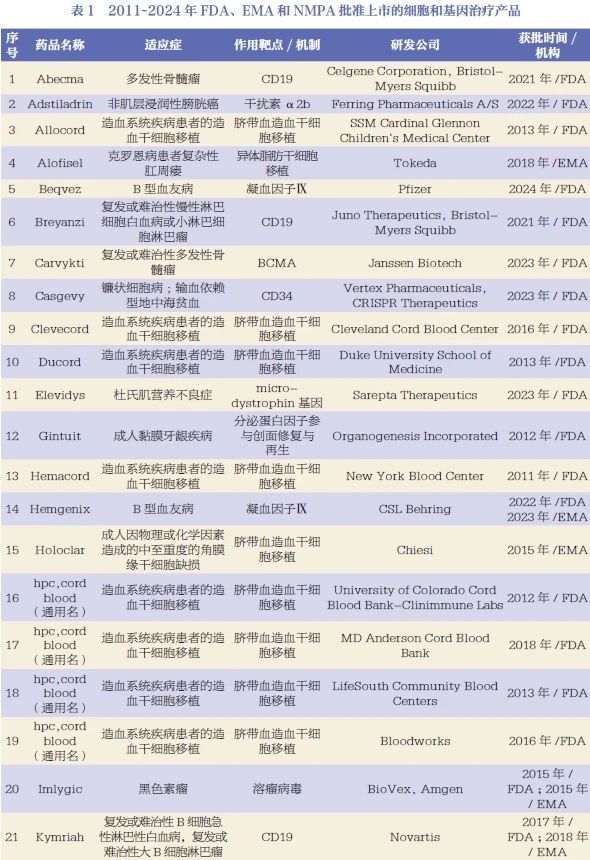
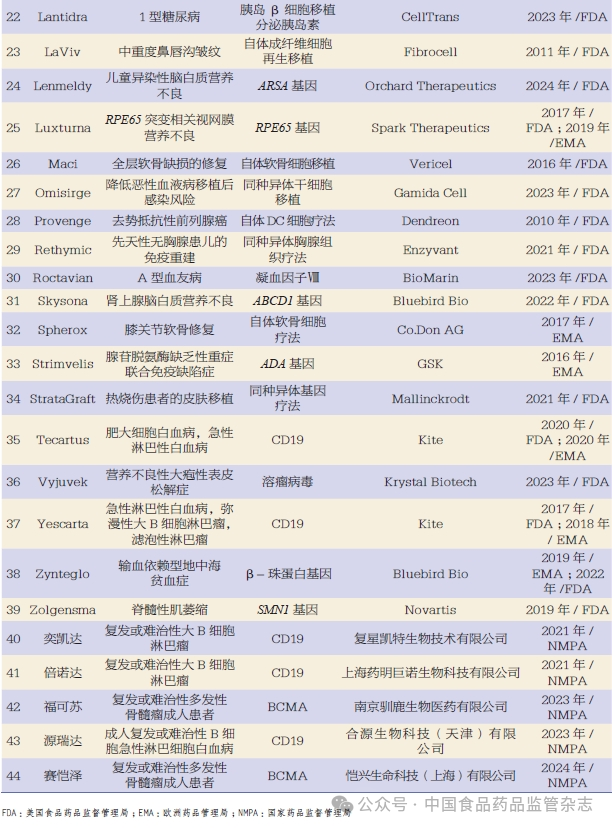
目前,细胞和基因治疗产品已在恶性肿瘤和遗传病等领域取得了重大进展。恶性肿瘤治疗领域,全球首款溶瘤病毒药物重组人5型腺病毒注射液(商品名:安柯瑞,上海三维生物技术有限公司)[5]于2005年获得我国药品监督管理部门批准治疗鼻咽癌。2017年,全球首个CAR-T产品Kymriah(美国Novartis公司)[6]被美国食品药品监督管理局(Food and Drug Administration,FDA)批准治疗淋巴瘤。同年,Yescarta(美国Kite公司)[7]获得FDA批准,适应症也是淋巴瘤,成为全球第二款CAR-T产品。截至目前,我国国家药品监督管理局(National Medical Products Administration,NMPA)共批准5款CAR-T产品:2021年6月批准阿基仑赛注射液(商品名:奕凯达,复星凯特生物技术有限公司)上市[8]和2021年9月批准瑞基奥仑赛注射液(商品名:倍诺达,上海药明巨诺生物科技有限公司)上市[9],均用于治疗复发或难治性大B细胞淋巴瘤;2023年6月批准伊基奥仑赛注射液(商品名:福可苏,南京驯鹿生物医药有限公司)上市[10],用于治疗复发或难治性多发性骨髓瘤成人患者;2023年11月批准纳基奥仑赛注射液[商品名:源瑞达,合源生物科技(天津)有限公司]上市[11],用于治疗成人复发或难治性B细胞急性淋巴细胞白血病;2024年2月批准泽沃基奥仑赛注射液[商品名:赛恺泽,恺兴生命科技(上海)有限公司]上市[12],用于治疗复发或难治性多发性骨髓瘤成人患者。
遗传性罕见病治疗领域,多款产品也被批准上市用于输血依赖型地中海贫血、脊髓性肌萎缩、重症联合免疫缺陷、杜氏肌营养不良症等的临床治疗。例如,美国Bluebird Bio公司研发的针对地中海贫血的基因药物Zynteglo于2019年被欧洲药品管理局(European Medicines Agency,EMA)批准上市,用于治疗输血依赖型地中海贫血;美国Novartis公司研发的Zolgensma于2019年5月被FDA批准上市,用于治疗2岁以下患者的脊髓性肌萎缩;英国葛兰素史克(GSK)公司研发的Strimvelis于2016年5月被EMA批准上市,用于治疗腺苷脱氨酶缺乏性重症联合免疫缺陷症;Elevidys是由美国Sarepta Therapeutics公司与瑞士Roche公司联合开发的腺相关病毒基因疗法,2023年6月被FDA加速批准上市,适应症是4~5岁可独立行走儿童的杜氏肌营养不良症;美国EditasMedicine公司研发的CRISPR/Cas基因药物EDIT-101用于治疗先天性黑蒙症10型(LCA-10),该药尚处于临床研究阶段。
目前,细胞和基因治疗产品的临床应用领域逐渐扩大,在慢性病和传染病等治疗领域的应用也在逐渐增加,为患者用药提供了新选择。例如,美国CellTrans公司开发的细胞治疗药物Lantidra于2023年6月获得FDA批准用于治疗1型糖尿病。美国Lexeo Therapeutics公司研发的LX1001,是一种用于APOE4相关阿尔茨海默病的基因治疗药物;美国GeneTechnologies公司基于慢病毒载体的治疗药物AGT103-T被用于治疗艾滋病。以上两款产品尚处于临床研究阶段。
1.2 产业现状
据IQVIA报告统计,截至2023年底,总计76款细胞和基因治疗产品获得全球监管机构的批准上市,获批数量是2013年的两倍以上[13]。本文列举了2011~2024年FDA、EMA和NMPA批准上市的细胞和基因治疗产品[8-15],见表1。通过分析全球细胞和基因治疗产品的研发情况可以看出,细胞和基因治疗产品的临床试验开展主要集中在美国、中国、欧盟、加拿大、日本、韩国、澳大利亚等国家和地区,其中我国和美国临床试验数量占比最高,据我国国家药品监督管理局药品审评中心2023年9月发布的数据[16],2022年在我国登记的细胞和基因治疗产品临床试验数量有46项。
2016年,美国通过《21世纪治愈法案》(21st Century Cures Act),旨在推动新药研发,加快审批过程,促进药品和医疗器械上市。2022年和2023年,先后颁布了《国家生物技术和生物制造计划》(National Biotechnology and Biomanufacturing Initiative)和《美国生物技术和生物制造的明确目标》(Bold Goals for U.S. Biotechnology and Biomanufacturing),以确保美国在生物技术领域的“竞争优势”。据IQVIA报告统计[13],FDA过去5年内批准的细胞和基因治疗产品中,高达86%的项目至少获得了一种FDA加速研发的资格认定。其中,71%的治疗产品被授予突破性疗法认定,64%的治疗产品获得了快速通道资格,均显著超过非细胞和基因治疗产品的比例。在全球范围内,其他监管机构也为细胞和基因治疗产品的开发提供了加速途径,例如EMA的PRIME认定、加速评估和附条件上市。
20世纪90年代,我国已开展细胞和基因治疗产品的临床研究,主要用于治疗血友病。2005年,药品监管部门批准重组人5型腺病毒注射液上市,用于治疗鼻咽癌。2010年后,药企和研发机构开始重点关注细胞治疗。随着监管体系的完善和技术指南的出台,细胞和基因治疗产业高速发展,相关制药公司争相布局,多种细胞和基因治疗产品进入临床研发阶段。
02 我国细胞和基因治疗产品监管政策发展
2.1 监管政策发展历程
20世纪90年代初,我国就有细胞和基因治疗临床试验方面的报道,但当时的监管体系尚不完善[17]。1993年,监管部门发布了《人的体细胞治疗及基因治疗临床研究质控要点》[18],规范了细胞和基因治疗临床研究的质量控制要点,对促进相关产业发展起到重要作用。1999年,国家药品监管部门发布了《药品临床试验管理规范》[19]、《新生物制品审批办法》(已失效)[20],将细胞和基因治疗产品纳入药品临床试验和新生物制品的监管范畴。2003年,《人基因治疗研究和制剂质量控制技术指导原则》[21]发布,我国逐步加强了对基因治疗产品的监管。2017年,国家药品监管部门组织制定了《细胞治疗产品研究与评价技术指导原则(试行)》[22],提出了涉及细胞治疗产品安全、有效、质量可控的一般技术要求,规范了细胞治疗类产品的研究、开发与评价。2019年4月,“细胞和基因治疗产品技术评价与监管体系研究”作为重点领域被纳入中国药品监管科学行动计划[23-24]。2020年发布的《生物安全法》推动了国家生物安全体制机制的建立。在加强监管的同时,2016年开始相关监管部门还陆续出台了鼓励细胞和基因治疗产业发展的政策文件。2022年5月,我国首部生物经济五年规划《“十四五”生物经济发展规划》发布,提出服务国家重大区域战略,引导创新资源向京津冀、长三角、粤港澳大湾区集聚发展。利用好长三角、粤港澳大湾区药品与医疗器械技术审评检查分中心,鼓励依托自由贸易试验区、海南自由贸易港在细胞治疗、中药和中医医疗器械注册监管等领域开展改革试点。
近年来,随着国家及地方各项产业政策的审慎出台,细胞和基因治疗产品的监管框架逐步清晰,企业管理日趋严格,逐步形成了技术和产业促进、权利保护和风险控制相协调的综合性监管政策体系。相关法律法规及政策主要包括[4,25-33]:《国家卫生计生委关于取消第三类医疗技术临床应用准入审批有关工作的通知》《“十三五”国家科技创新规划》《“十三五”国家战略性新兴产业发展规划》《“十三五”生物产业发展规划》《战略性新兴产业重点产品和服务指导目录(2016版)》《生物技术研究开发安全管理办法》《国务院关于印发6个新设自由贸易试验区总体方案的通知》《生物安全法》《国务院办公厅关于全面加强药品监管能力建设的实施意见》《“十四五”生物经济发展规划》等。
2.2 主要技术评价文件
在经历了规范化发展后,我国对于细胞和基因治疗产品的监管已基本形成比较全面的监管和技术评价政策体系。本文简要梳理了我国细胞和基因治疗产品的主要技术评价文件。主要包括[22,34-46]:《干细胞临床研究管理办法(试行)》《干细胞制剂质量控制及临床前研究指导原则(试行)》《细胞治疗产品研究与评价技术指导原则(试行)》《免疫细胞治疗产品临床试验技术指导原则(试行)》《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》《细胞治疗产品生产质量管理指南(试行)》《人源干细胞产品药学研究与评价技术指导原则(试行)》《基因治疗产品长期随访临床研究技术指导原则(试行)》《基因治疗产品非临床研究与评价技术指导原则(试行)》《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》《溶瘤病毒类药物临床试验设计指导原则(试行)》《体内基因治疗产品药学研究与评价技术指导原则(试行)》《体外基因修饰系统药学研究与评价技术指导原则(试行)》《基因治疗血友病临床试验设计技术指导原则》《溶瘤病毒产品药学研究与评价技术指导原则(试行)》等。
03 我国细胞和基因治疗产品发展面临的挑战
目前,从相关政策和措施、市场、人才等情况来看,我国的细胞和基因治疗产品表现出较大的发展前景。与此同时,作为一种新的治疗模式,尚存在一定的问题和挑战,笔者对其进行了归纳,主要包括以下3方面。
技术层面的挑战。①细胞和基因治疗产品的设计和制备工艺可能涉及细胞的采集、体外培养扩增、分离纯化、活化,或载体选择、基因修饰、基因编辑等,其操作复杂且不同产品的特点和生产工艺可能各不相同。因此,建议企业从原料采集到患者使用的全过程均采取特殊控制措施,并根据全面的风险识别和评估结果,制定合理的质量风险控制策略。②治疗反应个体差异可能较大,部分患者接受治疗前已接受过多线治疗,甚至处于终末期阶段,疾病进展较快。因此,建议根据患者的不同条件(包括是否需要对患者进行预处理,疾病的种类、分期、严重程度或进展速度等),在产品质量、生产周期、贮存方式或运输时间等方面,制定个性化、精准化的策略。③临床研究进展慢,适应症单一,2022年在我国登记的46项细胞和基因治疗产品临床试验,占比最大的适应症是肿瘤(54.4%),Ⅰ期临床试验占比超过45.7%,Ⅲ期临床试验占比却不足5%[16]。因此,建议企业调整研发思路,进行差异化设计,聚焦更多靶点和适应症,以避免临床资源和患者资源的过度消耗。此外,还建议监管部门简化审批流程(包括伦理审查、遗传资源审查等),提高临床试验启动速度,增加临床试验机构核心专业人才引进力度,同时加强人员培训,从根本上提升实施临床研究的质量水平。
监管层面的挑战。由于细胞和基因治疗具有较高的复杂性,对其研发、生产等环节的监管也较为复杂,笔者探索性地提出了几点监管建议:①优化监管机制,设立专门部门,专职负责细胞和基因治疗产品的审评审批、现场检查、检验等,建立针对细胞和基因治疗产品沟通交流、优先审评审批绿色通道,以提高企业与监管机构的沟通机会和沟通效率,节省沟通时间和成本,加快产品研发和上市进程。另外,我国细胞和基因治疗产品监管采取的是“双轨制”监管体系,因此,需要厘清医院和企业的监管路径。②要加强知识产权保护、呵护创新生态和土壤,更要注重信息的公开,发挥监管方数据枢纽的作用,汇总分析申报数据,将可以公开、能够引导企业避免同质化竞争以及需要关注的共性问题等以恰当的方式予以公开,为行业发展赋能。③加强相关技术指南、指导原则的宣贯与培训,搭建问题反馈平台,畅通监管方、申办者、研究者以及患者与患者家属之间的沟通对接渠道,持续提升各方对法律法规、技术指南、指导原则的理解和运用的一致性,并根据认知水平的提高,不断优化调整监管政策法规。④加强与相关监管部门的交流互动,积极参与细胞和基因治疗产品国际化标准的起草和制定,为国产品牌走向国际市场创造条件。
财务层面的挑战。高成本是细胞和基因治疗产品市场增长面临的挑战。例如,2024年3月在美国上市的基因治疗产品Lenmeldy定价400万美元/支,目前在我国上市的国产细胞治疗产品的定价也均超过100万元/支。价格高昂的原因之一是生物制药本身研发投入、生产成本较高,投资商需要从这种高风险业务中获得成本补偿。另一个原因是新兴治疗药物产品市场相对较小。例如。基因治疗药物Zynteglo、Zolgensma、Elevidys获批适应症分别为输血依赖型地中海贫血、脊髓性肌萎缩、杜氏肌营养不良症等罕见病。因此,针对财务挑战,笔者提出2方面建议:①建议由政府主导,建立多元化医保支付体系、探索新型支付方式(例如Zynteglo上市时就推出一次性支付药费后,若患者未获得治疗效果,退还部分费用)。②引导企业提升产品在物料供应、生产流程等方面的标准化、规模化水平,实现仪器设备、试剂、耗材等的国产化替代,重建供应链,降低生产成本。
04 结语
相较于处于发展成熟期的化学药品和迅速发展期的小分子靶向治疗药物、抗体药物,我国细胞和基因治疗产品发展时间短,属于新型治疗药物,尚处于起步阶段,相关企业规模较小、市场竞争者少、市场潜力大。但在政策扶持和技术不断创新的背景下,细胞和基因治疗产业将会实现快速发展,助力我国生物医药产业进入新阶段。因此,应抓住机遇、抢占先机,监管部门与企业同向发力,加大创新研发攻关、提高关键核心技术原始创新,盘活临床资源、降本增效,提高药物可及性。
此外,我国尚未在法规层面正式对该类药品进行定义和分类,根据2020年发布的《生物制品注册分类及申报资料要求》,细胞治疗和基因治疗产品属于治疗用生物制品中的一类。不过,考虑到细胞和基因治疗产品主要体现产品物质基础,相对局限,建议采用先进治疗药品作为这类产品的中文名称,具体描述为:“先进治疗药品是指经体外操作生产并在体内发挥作用的细胞治疗药品、基因治疗药品或组织工程药品,以及采用其他先进技术/方法生产的创新型药品等。”[47]科学的命名与分类有利于进一步加速相关药品的上市进程,以满足人民群众未被满足的临床需求。
参考文献:略
*本文来源 - - 中国食品药品监管杂志,作者:史海涛,谢正福*,何本霞,邹毅
相关文件下载、服务及学习课程:
合规培训:AAV基因治疗产品CMC开发的合规实践
委托定制:药品注册申请
联系专家,获取专家指导意见:e邀专家
*以上文章仅代表作者个人观点。本文为转载文章,版权归原作者所有,如涉侵权,请联系我们删除。
最新推荐
热门观点

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。

化妆品生产许可证申请
1.提供《化妆品生产许可证》新开办、变更、延续办理业务。 2.诚信经营、正规辅导拿证。 3.提交需求获取服务报价。

药品上市许可转让
对于新药法实施下,药品上市许可持有人可以转让药品上市许可,为企业申请转让批文、收购批文提供一站式服务指导。

药品经营许可证(批发、零售连锁总部)核发
1.开办药品批发、药品零售连锁总部企业,需向所在地省级药品监督管理部门申请,取得《药品经营许可证》。 2.CIO辅导药品零售连锁企业总部筹建和验收,帮助企业顺利拿证。

医疗器械注册证办理服务
1.CIO提供国内/进口二类医疗器械注册办理一站式服务。 2.CIO提供国内/进口三类医疗器械注册办理一站式服务。

药品GSP模拟飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

药品GSP年度服务
药品经营基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械GMP年度服务
器械生产基础课程体系; 每月两次以上更新课程; 每周一次在线集中答疑。

医疗器械模拟GMP飞检
上门全面审计企业合规风险,指导企业整改提高; 赶在飞检之前指导企业彻底整改缺陷; 大大降低被飞检停产、撤证的几率。

FDA审计服务/FDA认证
为客户提供全方位的FDA审计咨询、准备与实施,以确保企业顺利通过审计并顺利进入美国市场。

药品生产许可证B证核发
1.药品上市许可持有人取得药品批文后,委托生产的,需办理药品生产许可证B证才能合法上市销售。 2.CIO提供药品生产许可证办理业务,帮助您的批文产品尽快上市。

MAH申请
1.加快研发机构实现批文产品上市。 2.帮助医药公司实现批文产品转让。 3.协助药企实现受托生产。

药厂筹建
1.提供GMP药厂全套解决方案。 2.解决客户关于建设符合GMP要求的药厂的若干问题。 3.帮助顺利筹建药厂。

药品生产许可证A证核发申请
辅导企业完善硬件、软件, 整理生产、注册资料,提交申请,获得《药品生产许可证》(A 证)。

GMP合规审计/GMP认证
1.为企业提供药品gmp审计/GMP认证服务。 2.帮助企业熟悉GMP符合性检查流程。 3.帮助企业顺利通过药品生产质量管理体系审核。

医疗器械GMP体系考核
服务于二类、三类医疗器械生产企业。CIO为医疗器械生产企业提供专业的、定制化质量管理体系,提高产品的质量管理,避免投资浪费,让企业在时效内快速性通过质量体系考核,加快产品上市历程。

化妆品注册备案
1.提供国产/进口特殊/普通化妆品注册备案服务。 2.帮助工厂及贸易商快捷高效的完成注册备案,助力产品上市。






