 查看详情
查看详情GERD治疗新篇章:遵循指导原则,提升药物研发与临床试验质量
GERD治疗新篇章:遵循指导原则,提升药物研发与临床试验质量2024年7月,国家局发布了《胃食管反流病治疗药物临床试验技术指导原则》,为GERD治疗药物的研发提供了技术指导。那么,GERD治疗药物研发中,疗效评估的主要指标包括哪些呢?包括食管PH监测、食管阻抗监测、食管压力监测、...
 查看详情
查看详情8月起,这些新规开始实施!涉及药品、中药饮片和质量受权人
8月起,这些新规开始实施!涉及药品、中药饮片和质量受权人《药品监督管理行政处罚裁量适用规则》8月1日起施行国家药监局印发《药品监督管理行政处罚裁量适用规则》,自2024年8月1日起施行。《规则》对药品监管行政处罚裁量工作进行了完善,要求各级药品监督管理部门落实执法责任制和过错责任...
 查看详情
查看详情征求意见8月20日截止!药用辅料和药包材生产质量管理规范来了!
征求意见8月20日截止!药用辅料和药包材生产质量管理规范来了!近日,国家药监局综合司起草并发布了《药用辅料生产质量管理规范》和《药包材生产质量管理规范》的征求意见稿,向社会公开征求意见。意见反馈将截止于2024年8月20日。那么,对于企业来说,加强药用辅料和药包材质量监管,需要注...
 查看详情
查看详情药品生产许可A证能转B证吗?怎么转?流程资料要求?
药品生产许可A证能转B证吗?怎么转?流程资料有什么要求?随着MAH政策的全面施行,不少朋友咨询CIO,A证企业能不能转B证?要怎么转?A证转B证,实际上是做生产场地的变更。根据《药品上市后变更管理办法(试行)》第十四条,我们可知:境内持有人变更生产企业,就包括了持有人自行生产变更...
 查看详情
查看详情新政| 7月初起试行,提交药品注册 电子申报资料新方式来了!
7月初起试行,提交药品注册 电子申报资料新方式来了!为了提升药品注册申请人提交电子申报资料的效率,国家药监局药审中心发布了“以网络传输方式提交药品注册电子申报资料”的试行通知,在使用光盘提交电子申报资料的基础上,增加了网络传输方式。自7月1日起,申请人可通过网络传输方式提交药品注...
 查看详情
查看详情新版GMP血液制品附录修订稿发布,原料血浆管理应当注意什么?
新版GMP血液制品附录修订稿发布,原料血浆管理应当注意什么?6月11日,国家药监局发布了新版GMP血液制品附录修订稿,修订的主要内容增加了血液制品生产、检验环节信息化和可视化的相关要求。那么,针对新增内容,生产企业在原料血浆管理过程中应当注意以下几点:1、原料血浆的来源与质量控制...
 查看详情
查看详情7月起,这些新规开始实施!涉及药品、医疗器械、医保目录...
7月起,这些新规开始实施!药械企业请注意!新修订《医疗器械经营质量管理规范》发布 7月1日起施行国家药监局发布新修订《医疗器械经营质量管理规范》,《规范》由原来的九章66条,修订为十章116条。其中,“质量管理体系建立与改进”一章为新增章节,包括质量管理体系建立、制定质量方针和质...
 查看详情
查看详情新规:针对中药口服制剂,如何合理建立生产过程质量控制方式?
针对中药口服制剂,如何合理建立生产过程质量控制方式?6月24日,国家药审中心发布实施了《中药口服制剂生产过程质量控制研究技术指导原则(试行)》。其中,该《指导原则》就生产过程质量控制方式的建立作了详细的叙述,CIO梳理了以下重点内容,生产企业应及时调整:1、在方法与技术上:企业需...
 查看详情
查看详情血液制品生产智慧监管行动,推动生产企业信息化管理!
血液制品生产智慧监管行动,推动生产企业信息化管理!日前,国家药监局发布了《血液制品生产智慧监管三年行动计划(2024—2026年)》。旨在2026年底前,基本实现血液制品生产企业信息化管理。那么,血液制品生产企业应当做到哪几点呢?1、在血浆接收环节,生产企业必须建立信息化系统,对...
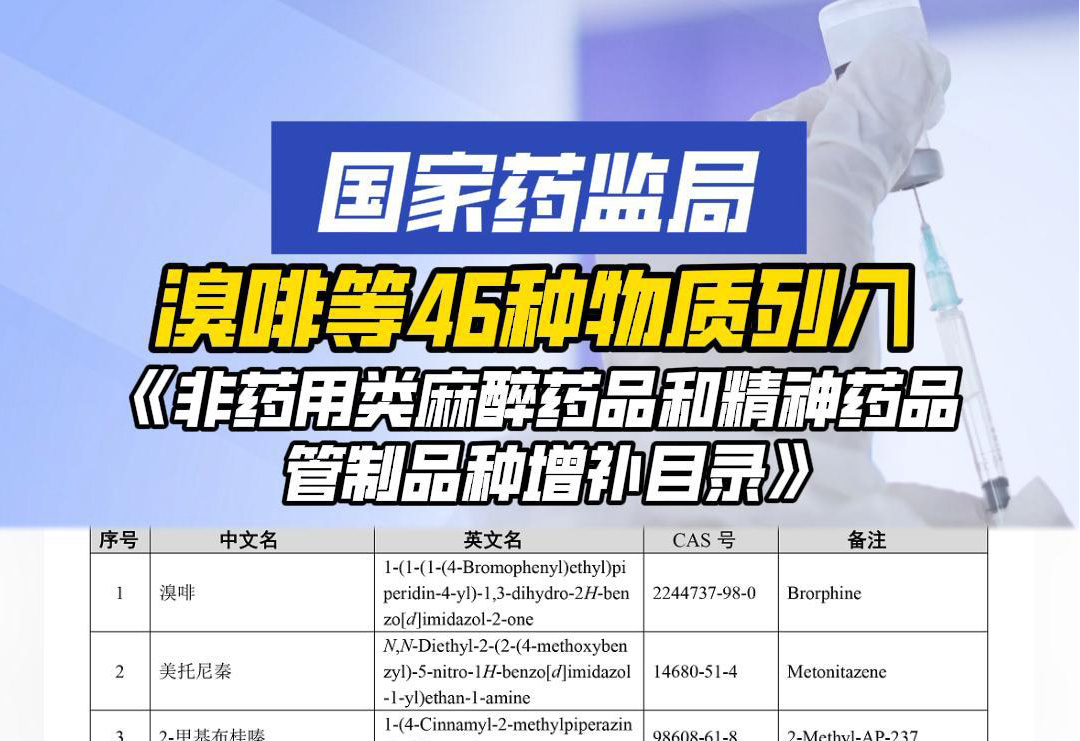 查看详情
查看详情





