
药用辅料登记
1.CIO提供国产药用辅料登记、更新和年度报告服务。 2.CIO提供进口药用辅料登记、更新和年度报告服务。
参考价格 ¥0.00 ¥0.00
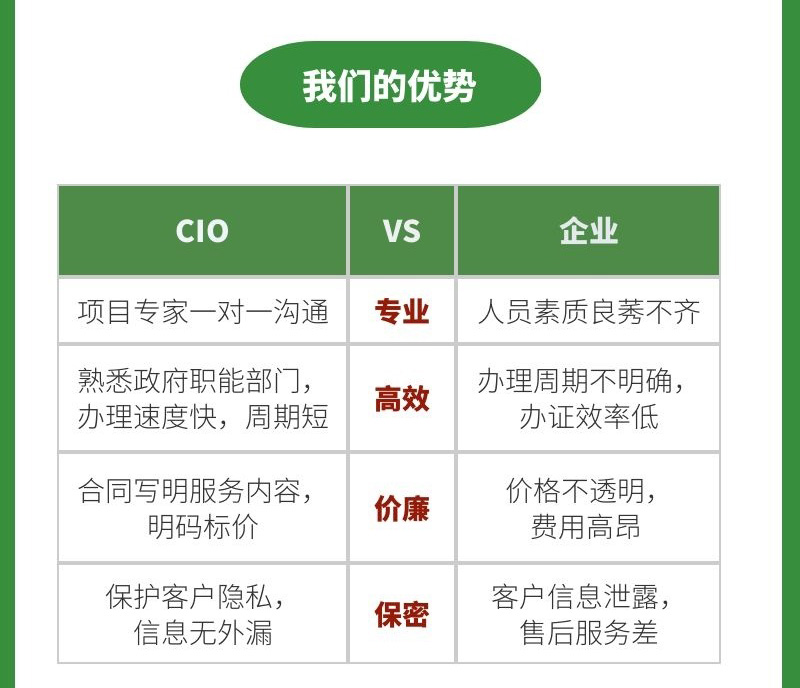
典型案例 中海壳牌:药品生产+注册、药用辅料登记


药用辅料登记法律依据
1.《中华人民共和国药品管理法》
2.《中华人民共和国药品管理法实施条例》
3.《药品注册管理办法》
4.总局关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号)
5.国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年 第56号)
药用辅料登记资料要求
一般要求
国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年第56号)
附件:1.药用辅料登记资料要求(试行)
变更后
1、药用辅料的变更应及时在登记平台更新信息,并在每年第一季度提交的上一年年度报告中汇总。
2、药用辅料变更时药用辅料登记人应主动开展研究,并及时通知相关药品制剂生产企业(药品上市许可持有人),并及时更新登记资料,并在年报中体现。
境外辅料供应商更换登记代理机构
境外辅料供应商更换登记代理机构的,提交相关文件资料后予以变更。包括:变更原因说明、境外辅料供应商委托书、公证文书及其中文译本、新代理机构营业执照复印件、境外辅料供应商解除原代理机构委托关系的文书、公证文书及其中文译本。
药用辅料登记服务内容
1.为境外生产药用辅料提供注册代理服务。
2.对登记资料进行差距分析,风险评估并指导客户进行补充完善。
3.负责外文登记资料的专业翻译、校对。
4.负责登记资料编写、整理及递交。如有需要,可提供登记资料编写大纲、证明性文件模板。
5.全程跟踪CDE审评进度,积极与审评员沟通、回复专家提问或递交补充资料。
6.指导CDE技术审评过程中补充资料内容回复及资料递交。
7.如有需要,可负责注册检验申请、送样、跟踪及问题解决。
8.如有需要,可协助GMP部门为延伸检查提供服务。
9.药用辅料登记资料变更维护,包括重大变更、中等变更、微小变更及基础信息变更。
10.年度报告资料制作与提交。









